
| A. | 每生成1mol Fe3O4,反应转移的电子总数为4mol | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为1:5 | |
| C. | 3mol Fe2+被氧化时,消耗O2标准状况下的体积约为22.4L | |
| D. | x=4 |
分析 从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,
反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.
解答 解:A.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,需要氧气1mol,反应转移的电子总数为4mol,故A正确;
B.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,则3Fe2+和2S2O32-为还原剂,O2为氧化剂,所以氧化剂与还原剂物质的量之比为1:5,故B正确;
C.3mol Fe2+被氧化时,失去8-6=2mol电子,则被Fe2+还原的O2的物质的量为2×$\frac{1}{4}$mol=0.5mol,故C错误;
D.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故D正确.
故选C.
点评 本题考查氧化还原反应,题目难度中等,明确各元素的化合价变化是解答该题的关键.


科目:高中化学 来源: 题型:解答题
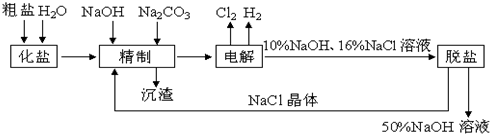
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 光照氯水有气泡冒出,该气体主要为Cl2 | |
| C. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| D. | Na[Al(OH)4]溶液和盐酸可以通过相互滴加的方法来鉴别,NaHCO3溶液和Ca(OH)2溶液也可以通过相互滴加的方法来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知CaO+H2O═Ca(OH)2放出大量的热,故可把该反应设计成原电池 | |
| B. | 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁做负极、铜做正极 | |
| C. | 理论上说,任何能自发进行的氧化还原反应都可设计成原电池 | |
| D. | 某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol/L的Ba(NO3)2溶液中含NO3-离子数为2NA | |
| D. | 分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0且△S>0的反应肯定是不自发的 | B. | △H<0且△S<0的反应肯定是自发的 | ||
| C. | △H>0且△S>0的反应肯定是自发的 | D. | △H<0且△S>0的反应肯定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Br-、Cu2+ | D. | Na+、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
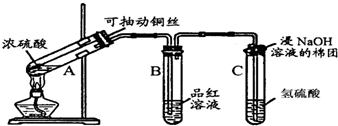
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com