
| A. | H2O2的电子式: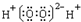 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | S2-的结构示意图: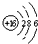 | D. | CO2的比例模型: |
分析 A.双氧水为共价化合物,不存在阴阳离子;
B.次氯酸分子中含有1个H-O键和1个O-H键;
C.硫离子的核电荷数为16,核外电子总数为18,最外层满足8电子稳定结构.
D.二氧化碳分子中,C原子的原子半径大于O原子.
解答 解:A.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水正确的电子式为 ,故A错误;
,故A错误;
B.次氯酸为共价化合物,最小原子为O原子,其结构式为:H-O-Cl,故B正确;
C.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为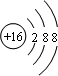 ,故C错误;
,故C错误;
D.二氧化碳为直线型结构,其正确的比例模型为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及比例模型、离子结构示意图、结构式、电子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 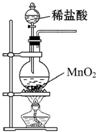 制取少量Cl2 | |
| B. | 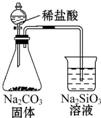 证明非金属性Cl>C>Si | |
| C. | 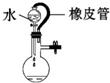 水不能持续流下,说明装置气密性良好 | |
| D. | 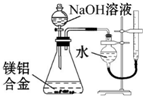 测定镁铝合金中铝的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
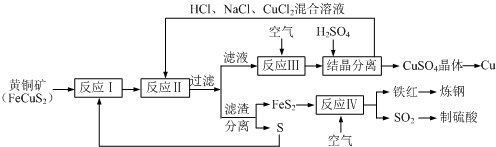
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4 | B. | 稀HNO3 | C. | 盐酸 | D. | CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(O2)=0.0025 mol/(L•s) | B. | v(NO)=0.008 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.002 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 )和抗癫痫药物H(
)和抗癫痫药物H(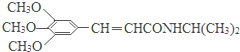 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):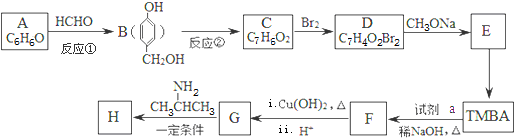
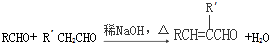 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)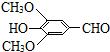 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→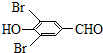 +2HBr.
+2HBr.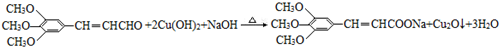 .
. )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
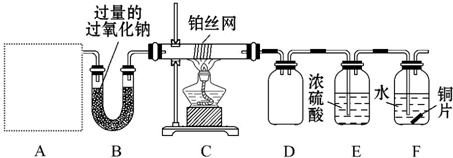
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
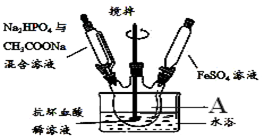 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;| 梨汁 | 苹果汁 | 橙汁 | 0.04%的Vc溶液 | |
| 滴加的滴数 | 40 | 20 | 10 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com