
����(H3BO3)��Һ�д������·�Ӧ��H3BO3(aq)��H2O(l)  ?[B(OH)4]��(aq)��H��(aq)������˵����ȷ����
?[B(OH)4]��(aq)��H��(aq)������˵����ȷ����
| ��ѧʽ | ���볣��(298 K) |
| H3BO3 | K��5.7��10��10 |
| H2CO3 | K1��4.4��10��7 K2��4.7��10��11 |
| CH3COOH | K��1.75��10��5 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
| A��NaHCO3��Һ��ˮϡ�ͣ�c(Na+)/c(HCO3��)�ı�ֵ�������� |
| B��1 mol��L��1��NH4Cl��Һ�к���NH4+����Ŀһ��С��NA |
| C����ʯī�缫���FeCl3��Һ��������Ӧ��2Fe3+��6H2O��6e����2Fe(OH)3����3H2�� |
| D���������෴��ɵĽ����ϣ�һ������ֽ���۳����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ��0.1 mol Na2CO3�����������õ�һ�����Ϊ1 L����Һ����Һ�в�������pH �Ĺ�ϵ����ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ���ǣ� ��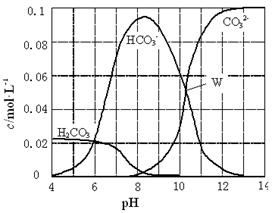
| A��W����ʾ����Һ�У�c(Na+)+ c(H+)��2c(CO32��)+ c(OH��)+ c(Cl��) |
| B��pH��4����Һ�У�c(H2CO3)+ c(HCO3��)+ c(CO32��)��0.1 mol��L��1 |
| C��pH��8����Һ�У�c(H+)+ c(H2CO3)+ c(HCO3��)��c(OH��)+c(Cl��) |
| D��pH��11����Һ�У�c(Na+)��c(Cl��)��c(CO32��)��c(HCO3��)��c(H2CO3) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��0.1 mol ��������Һ����CH3COOH����NaOH����CH3COONa������˵����ȷ����
��������Һ����CH3COOH����NaOH����CH3COONa������˵����ȷ����
| A����Һ���У�C(CH3COO��)=C(H��) |
| B����Һ�١��ڵ������ϣ����Һ��c(CH3COO��)������Һ���е�C(CH3COO��) |
| C����Һ�١��ڵ������ϣ����Һ��c(CH3COO��)+ c(CH3COOH)= C(Na+) |
| D����Һ�١��۵������ϣ����Һ��C(Na+)>C(CH3COO-)> C(H��)>C(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ʹ0.1mol/L��NaHCO3��Һ��c(H+)��c(CO32-)��c(HCO3-)������
| A��ͨ�������̼���� | B�������������ƹ��� |
| C��ͨ���Ȼ������� | D�����뱥��ʯ��ˮ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
��NaHCO3��Һ��ˮϡ�ͣ�c��Na+��/ c��HCO3�����ı�ֵ��������
��Ũ�Ⱦ�Ϊ0��1 mol��L-1��Na2CO3��NaHCO3�����Һ��2c��Na+��=3[c��CO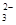 ��+c��HCO
��+c��HCO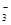 ��]
��]
����0��1 mol��L-1��ˮ�еμ�0��lmol��L-1���ᣬǡ����ȫ�к�ʱpH=a������ˮ���������
c��OH-��=l0��amol��L-1
����֪��Ksp��AgCl��=1��8xl0-10�� Ksp��A92Cr2O4��=2��0��l0-12����Ag2CrO4���ܽ��С��AgCl
| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
50��ʱ�����и���Һ�У����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ����
| A��pH=4�Ĵ����У�c(H+)=4.0mol?L��1 |
| B������С�մ���Һ�У�c(Na+)= c(HCO3��) |
| C������ʳ��ˮ�У�c(Na+)+ c(H+)= c(Cl��)+c(OH��) |
| D��pH=12�Ĵ�����Һ�У�c(OH��)=1.0��10��2mol?L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪�¶�Tʱˮ�����ӻ�����ΪKW�����¶��£���Ũ��Ϊamol��L-1��һԪ��HA��bmol��L-1��һԪ��BOH�������ϣ����ж�����Һ�����Ե�������
| A��a=b |
| B�������Һ��PH=7 |
C�������Һ�У�c��H+��=  mol.L-1 mol.L-1 |
| D�������Һ��c(H+)+c(B+)=c(OH-)+C(A-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ȷ����
| A��pH��5��CH3COOH��Һ��pH��5��NH4Cl��Һ�У�c(H��)��� |
| B��Na2CO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ�pH��Kw����С |
| C��pH=12��Ba(OH)2��Һ��pH=12��Na2CO3��Һ�У�ˮ�����c(H��)ǰ�ߴ� |
| D��0.1 mol��L��1CH3COONa��Һ�У�c(Na��)��c(CH3COO��)��c(H��)��c(OH��) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com