
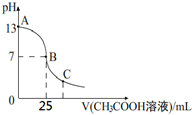
 25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )
25℃时,向25mL 一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,溶液pH和加入的醋酸溶液的体积关系曲线如图所示.下列有关混合溶液说法错误的是( )| A. | A、B间的溶液中可能有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | B点:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) | |
| C. | C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | NaOH溶液和醋酸溶液的浓度都恰好为0.1 mol•L-1 |
分析 25℃时,向25mL一定浓度的 NaOH溶液中逐滴加入某浓度的 CH3COOH溶液,二者恰好中和时溶质为CH3COONa溶液,溶液呈碱性,而图象中25mL NaOH溶液的pH为13,则NaOH的浓度为0.1 mol•L-1;向其中加入25mL CH3COOH溶液时溶液的pH=7,呈中性,说明此时酸稍过量,即酸的浓度应大于0.1 mol•L-1;然后结合电荷守恒、盐的水解原理对各选项进行判断.
解答 解:A.当氢氧化钠和醋酸恰好反应时,溶质为醋酸钠,溶液呈碱性,应该处于A、B之间,此时溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A正确;
B.B点时溶液的pH=7,溶液为中性,则c(OH-)=c(H+),根据电荷守恒可知:c(CH3COO-)=c(Na+),则溶液中离子浓度大小为:c(CH3COO-)=c(Na+)>c(OH-)=c(H+),故B正确;
C.C点时溶液呈酸性,则:c(H+)>c(OH-),结合电荷守恒可知:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.图象中25mL NaOH溶液的pH为13,则NaOH的浓度为0.1 mol•L-1,向其中加入25mL CH3COOH溶液时溶液的pH=7,呈中性,说明此时酸稍过量,即酸的浓度应大于0.1 mol•L-1,故D错误;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确图象中各点溶质组成为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,能够根据电荷守恒、物料守恒及盐的水解原理判断各离子浓度大小.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核内有l8个中子的氯原子:${\;}_{17}^{35}$Cl | |
| B. | S2-的结构示意图: | |
| C. | CO2分子比例模型: | |
| D. | H2O2的电子式: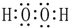 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ;
; ,
,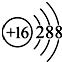
| A. | ①②③④⑤ | B. | ④⑤ | C. | ③④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡金属跟非金属元素化合时都能形成离子键 | |
| B. | 离子化合物熔融状态下一定导电 | |
| C. | 离子化合物中的阳离子只能是金属离子,酸根离子中不能含有金属元素 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
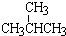 和
和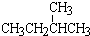 ; ②
; ②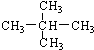 和
和 ; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 | ⑤⑥ | ①③ | ④⑧ | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: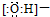 | B. | 硫原子的原子结构示意图: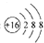 | ||
| C. | 乙烯分子的实验式:C2H4 | D. | 3,3一二甲基一1一戊烯的键线式: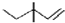 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com