
【题目】(1)等质量的氧气和臭氧(O3),它们的物质的量之比为__________,所含分子数之比为__________,所含原子数之比为__________。
(2)中和含0.2molHCl的稀盐酸,需NaOH固体的质量为__________g。
(3)某气态氧化物的化学式为RO2,标准状况下1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_____,R的相对原子质量为__________。
【答案】3:23:21:18.0g64g·mol-132
【解析】
(1)根据n=V/Vm=m/M=N/NA进行相关量的计算.
(2)根据氯化氢的物质的量及反应关系式计算出需要氢氧化钠的质量;
(3)根据n=V/Vm、M=m/M计算出RO2的摩尔质量,然后结合化学式组成计算出R的相对原子质量;
(1)设质量都为mg,则有:
n(O2):n(O3)=![]() =3:2,N(O2):N(O3)=3NA:2NA=3:2,由于都由O原子组成,则质量相同时O原子个数相同,比值为1:1,
=3:2,N(O2):N(O3)=3NA:2NA=3:2,由于都由O原子组成,则质量相同时O原子个数相同,比值为1:1,
故答案为:3:2;3:2;1:1.
(2)中和含0.2mol HCl的稀盐酸,根据反应的关系式:HCl~NaOH,需NaOH的质量为:40g·mol-1×0.2mol=8.0g,
故答案为:8.0;
(3)标准状况下448mL 64g·mol-1气体的物质的量为:0.448L/22.4L·mol-1=0.02mol,该气体的摩尔质量为:1.28g/0.02mol=64g·mol-1;RO2的相对分子质量为64,则R的相对原子质量为:64-16×2=32,
故答案为:64g·mol-1;32;


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】《化学与生活》化学和环境保护、食品营养、材料应用等密切相关。
(1)防治环境污染,营造安全的生态环境已成为全人类的共识。
①天然水中杂质较多,常需加入明矾、氯化铁等作混凝剂进行处理,混凝剂溶于水后生成的胶体可以吸附水中的悬浮颗粒。请以氯化铁为例,用离子方程式表示该净水原理_________。
②垃圾处理要遵循无害化、减量化和________的原则。
③在汽车尾气系统中装置催化转化器,由于含铅化合物会使____________,所以装有催化转化器的汽车必须使用无铅汽油。
(2)保证食品、药品安全,保持营养均衡,是人体健康的基础。
①人体需要的营养素主要有糖类、油脂、蛋白质、________、维生素和水。在氢、氮、铁、氯、钙这几种元素中,属于人体生命活动必需的微量元素是________。
②抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、淀粉。写出该抗酸药发挥功效时的离子方程式:__________________________。
③如果不注意控制酸性食物的摄入,就会导致血液偏酸,甚至形成“________症”,引起人体缺钙、血液黏度增大等。
④漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是____________________________。
(3)丰富多彩的材料为人类的生存和发展创造了完美的物质条件。
石英玻璃的主要成分为____________(填化学式)。有机玻璃受热时会软化,易于加工成型。有机玻璃是一种____________(选填“橡胶”或“纤维”或“塑料”)。有些塑料只是在制造过程中受热时能变软,可以塑制成一定的形状,但加工成型后就不会受热熔化,具有__________。橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为__________结构,从而增大橡胶的强度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L的HA溶液中 ![]() =1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
=1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是________。
(2)HA的电离方程式是________。其中由水电离出的c(H+)=________mol/L。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.![]() B.
B.![]() C.c(H+)与c(OH﹣)的乘积D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积D.c(OH﹣)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈________性,请用离子方程式解释其原因_______________________,混合溶液中各离子浓度由大到小的顺序是_______________________。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加 NaHSO4________mL。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过__________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目_________________________。
(2)为除去氯气中混有的杂质气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。
a. 碱石灰 b. 饱和食盐水 c. 浓硫酸 d. 饱和碳酸氢钠溶液
(3)③中发生反应的化学方程式______________________________________。比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是:_____________________。
(4)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________ (填写实验操作名称)。

(5)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为 _______,随后溶液逐渐变为无色,是因为发生了反应______________(写化学方程式)。
(6)一定量的氢气在过量氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4·2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:
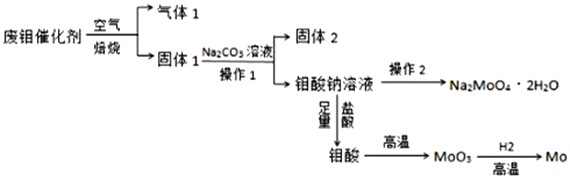
回答下列问题:
(1)可以提高焙烧效率的措施有____________________________________(填一条即可),MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若反应中生成0.1molMoO3,反应中转移电子的数目为____________;
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为______________________________;
(3)操作2为______________________________;
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为______________;
(5)已知钼酸钠溶液中c(MoO42-)=0.40molL-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为__________________;[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作所对应的现象以及结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热 | 铝箔熔化并滴落 | 金属铝的熔点较低 |
B | 先向某溶液滴加H2O2,然后再滴加几滴KSCN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 在KI溶液中滴加少量氯水,再加入CCl4,充分振荡 | 液体分层,下层溶液呈紫红色 | 氯的非金属性强于碘 |
D | 向1mL0.1mol/LMgCl2溶液中先滴1~2滴2mol/LNaOH溶液,再滴加2滴0.1mol/L FeCl3溶液,静置 | 先有白色沉淀生成,后白色沉淀变为红褐色 | Ksp[Mg(OH)2]<Ksp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com