
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物, E的阳离子与A的阴离子核外电子层结构相同。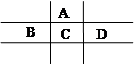
请回答下列问题:
⑴C元素在周期表中的位置为 。
⑵写出A与氢元素能形成原子物质的量之比为1∶1的化合物的结构式 ,分子中所含共价键的类型为 。
⑶比较A、C氢化物的稳定性:A C(填大于、小于或等于),原因是 。
⑷B、C、D的原子半径由大到小的顺序为(用元素符号表示) 。
⑸若将E制作成电极与石墨用导线相连,回答下列问题:
将两电极插入盛有稀H2SO4的烧杯中形成原电池,E电极为 极,写出该电池的负极的电极反应是: ;电池总反应(用离子方程式表示) 。
(15分)(1)第三周期VIA族(2分)
(2)H—O—O—H(1分);极性键、非极性键(写全得2分、不全得1分,多写为零分)。
(3)大于(1分);氧的非金属性大于硫的非金属性(2分,合理均给分)。
(4)P>S>Cl(2分,或P S Cl或Cl<S<P均给分。)
(5)负极(1分);Al-3e-=Al3+(2分) 2Al+6H+=2 Al3++3H2↑
(2分,未配平零分,元素符号写错零分,未写气体符号不扣分)
解析试题分析:设C元素的原子序数是x,则根据元素在周期表中的相对位置可知,A、B、D的原子序数分别是x-8、x-1、x+1,则x-8+x-1+x+x+1=56,解得x=16,即A是O,B是P,C是S,D是Cl元素。E的氢氧化物是两性氢氧化物,则E是Al元素。
(1)S元素的核电荷数是16,在周期表中的位置为第三周期VIA族。
(2)氧元素与氢元素形成原子物质的量之比为1∶1的化合物是双氧水,其的结构式H—O—O—H,分子中所含共价键的类型为极性键、非极性键。
(3)氧的非金属性大于硫的非金属性,非金属性越强,氢化物的稳定性越强,则水的稳定性强于H2S的稳定性。
(4)同周期自左向右原子半径逐渐减小,则B、C、D的原子半径由大到小的顺序为P>S>Cl。
(5)铝是活泼的金属,与石墨用导线连接后插入到稀硫酸中,铝是负极,失去电子,电极反应式是Al-3e-=Al3+;石墨是正极,溶液中的氢离子在正极得到电子,所以总的反应式是2Al+6H+=2 Al3++3H2↑。
考点:考查元素周期表第结构和元素周期律的应用
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


科目:高中化学 来源: 题型:填空题
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。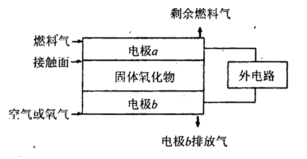
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若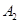 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若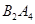 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
人民网西昌报道组10月1日电约19时26分,嫦娥二号宣布成功发射。据早些时候报道,昨天上午9时起,工作人员开始为“嫦娥二号”和长三丙火箭加注常规燃料,至14时30分左右加注的是燃烧剂;此后至18时左右加注氧化剂。

甲:嫦娥二号发射瞬间 乙:运行中的嫦娥二号
已知A、B、C、D是元素周期表中的四种短周期元素,且原子序数依次增大,A的单质是上述资料中的“燃烧剂”,C的单质是上述资料中的“氧化剂”;A元素原子中没有中子;bB与cC两种元素存在关系:b = c﹣1;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。
请解答下列问题:
(1)A元素在元素周期表第 族中,D元素在元素周期表第 周期中。
(2)B原子的原子结构示意图: 。
(3)A、B两种元素形成的四原子分子的电子式为 。
(4)上图甲中发生反应的化学方程式为: 。
(5)A、B形成的六原子分子BA2—BA2也可以作为火箭发射中的燃烧剂,此时往往使用A、C形成的四原子分子(A2C2)作为氧化剂。已知8g BA2—BA2与足量A2C2反应,生成物均为无害气体,放出热量为160.35kJ。
请写出上述反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出10电子微粒
①原子__ ___② 分子___________________________
③ 阴离子______________________④ 阳离子_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(8分)已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大。A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。回答下列问题:
(1)元素D在周期表中的位置是 。
(2)画出E的阴离子的结构示意图: 。
(3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式: 。
写出一种由A、C、D三种元素组成的共价化合物的化学式: 。
(4)将9 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中,
完全吸收后,溶液中大量存在的阴离子是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)根据下列某些短周期元素中元素性质回答问题。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | | +3 | +4 | +5 | +7 | +1 | +5 | |
| 最低价态 | -1 | | -2 | | -4 | -3 | -1 | | -3 | -1 |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为 ;
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA)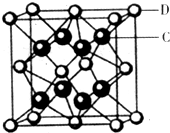
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | | | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com