
【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]() _____________
_____________![]() 。
。
(2)在容积均为![]() 的两个恒容密闭容器中发生反应
的两个恒容密闭容器中发生反应![]() ,有关数据如下:
,有关数据如下:
容器 | 温度 | 起始量 | 达到平衡 | |||
|
|
| CO转化率 | 所需时间 | ||
1 | 800 | 2 | 1 |
| 3 | |
2 | 800 | 1 | 2 | n | x | |
①![]() 时该反应的平衡常数
时该反应的平衡常数![]() ___________。
___________。
②容器2中,![]() ___________,
___________,![]() ___________。
___________。
③若![]() 起始时,在
起始时,在![]() 恒容密闭容器中加入CO、
恒容密闭容器中加入CO、![]() 、
、![]() 、
、![]() 各
各![]() ,则此时
,则此时![]() ___________
___________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)反应![]()
![]() 可用于捕捉空气中的
可用于捕捉空气中的![]() ,为研究温度对
,为研究温度对![]() 捕获
捕获![]() 效率的影响,在某温度
效率的影响,在某温度![]() 下,将一定量的
下,将一定量的![]() 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的![]() 气体,在t时刻,测得容器中
气体,在t时刻,测得容器中![]() 气体的浓度。然后分别在温度为
气体的浓度。然后分别在温度为![]() 、
、![]() 、
、![]() 、
、![]() 下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定
下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定![]() 气体的浓度,得到的曲线图如下:
气体的浓度,得到的曲线图如下:
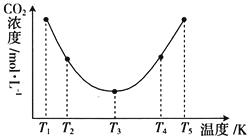
①![]() ____________
____________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 区间,
区间,![]() 变化的原因是_____________。
变化的原因是_____________。
②已知常温下![]() 的电离常数
的电离常数![]() ,碳酸的电离常数
,碳酸的电离常数![]() 、
、![]() ,则恰好完全反应时所得的
,则恰好完全反应时所得的![]() 溶液中
溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③在图中所示五种温度下,该反应的平衡常数最大的温度是____________。
【答案】![]()
![]()
![]() 或
或![]()
![]()
![]()
![]()
![]() 区间,化学反应未达到平衡,且温度越高,反应速率越快,相同时间内
区间,化学反应未达到平衡,且温度越高,反应速率越快,相同时间内![]() 溶液捕获的
溶液捕获的![]() 就越多,则剩余的
就越多,则剩余的![]() 气体浓度就越小
气体浓度就越小 ![]()
![]()
【解析】
(1)①CO(g)+2H2(g)=CH3OH(g) ΔH=-91 kJ·mol-1
②2CO2(g)=2CO(g)+O2(g) ΔH=+566 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
根据盖斯定律④CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=①+![]() +
+![]() =-91 kJ·mol-1+
=-91 kJ·mol-1+![]() 566 kJ·mol-1+
566 kJ·mol-1+![]() (-483.6 kJ·mol-1)=-49.8kJ·mol-1;
(-483.6 kJ·mol-1)=-49.8kJ·mol-1;
(2)由容器 1数据可知
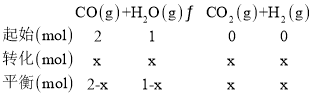
![]() ,x=
,x=![]() ,
,
①800℃时该反应的平衡常数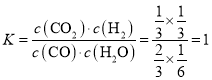 ;
;
②因为温度不变,则 K不变,
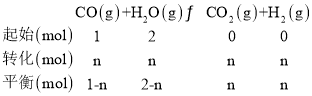
K=1= ,解得n=
,解得n=![]() ,x=
,x=![]() (或66.7%);
(或66.7%);
③若800℃起始时,在2 L恒容密闭容器中加入CO、H2O、CO2、H2各1 mol,根据Qc=1=K,则此时v正=v逆;
(3)在图中CO2的浓度存在一最低点,则在T1~T2区间,反应未达到化学平衡,温度升高,反应速率加快,CO2被捕捉的量增加,剩余CO2的浓度减小;T4~T5区间,反应已达到化学平衡,升高温度剩余CO2的浓度增大,即升高温度,平衡向左移动,因此正反应为放热反应,即ΔH<0;T1~T2区间,c(CO2)变化的原因是化学反应未达到平衡,且温度越高,反应速率越快,相同时间内(NH4)2CO3溶液捕获的CO2就越多,则剩余的CO2气体浓度就越小;
②由电离常数可知,![]() 的水解能力弱于
的水解能力弱于![]() 的水解能力,而
的水解能力,而![]() 的水解能力强于其电离能力,故溶液呈碱性即c(H+)<c(OH-);
的水解能力强于其电离能力,故溶液呈碱性即c(H+)<c(OH-);
③根据①可知该反应是放热反应,温度越高平衡常数越小,则在图中所示五种温度下,该反应的平衡常数最大的温度是T1。


科目:高中化学 来源: 题型:
【题目】实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数![]() ,称取此混合物
,称取此混合物![]() ,溶于水中,配成250mL溶液。
,溶于水中,配成250mL溶液。
方案一:沉淀法。利用化学反应把![]() 、
、![]() 完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中
完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中![]() 。
。
(1)量取100mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中![]() 、
、![]() 完全转化为沉淀,应选用的试剂是 ______
完全转化为沉淀,应选用的试剂是 ______ ![]() 填编号
填编号![]() .
.
A.![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法是 ______ ;
(3)将所得沉淀充分干燥,称量沉淀的质量为mg,由此可以计算![]() 。如果此步中,沉淀未干燥充分就称量,则测得
。如果此步中,沉淀未干燥充分就称量,则测得![]() ______
______ ![]() 填“偏大”、“偏小“或“无影响”
填“偏大”、“偏小“或“无影响”![]() 。
。
方案二:量气法.量取![]() 配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况
配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况![]() 约
约![]() 、
、![]() 的体积,由此计算混合物中
的体积,由此计算混合物中![]() 。
。
(1)装置中导管a的作用是 ______ 。
(2)若撤去导管a,使测得气体体积 ______ ![]() “偏大”,“偏小”或“无影响”
“偏大”,“偏小”或“无影响”![]() 。/span>
。/span>
方案三:滴定法.量取![]() 配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用
配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用![]() 的盐酸滴定到终点
的盐酸滴定到终点![]() 已知终点时反应
已知终点时反应![]() 恰好完全
恰好完全![]() 重复此操作2次,消耗盐酸的体积平均值为
重复此操作2次,消耗盐酸的体积平均值为![]() 。
。
(1)量取![]() 配制好的溶液,应选择 ______ 仪器来完成。
配制好的溶液,应选择 ______ 仪器来完成。
(2)判断滴定终点的依据是 ______ 。
(3)此法测得![]() ______ %。
______ %。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于化学反应方向说法正确的是 ( )
A.反应2A(g)+B(g) = 3C (s)+D(g)在一定条件下能自发进行,说明该反应的ΔH>0
B.常温下反应2Na2SO3(s)+O2(g)= 2Na2SO4(s)能自发进行,则ΔH<0
C.反应2Mg(s)+CO2(g)![]() C(s)+2MgO(s)能自发进行,则该反应的△H>0
C(s)+2MgO(s)能自发进行,则该反应的△H>0
D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的 △H<0 ,△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度________wmol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:________(用等式表示)。
(4)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d________b(填“>”“=”或“<”),理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】去甲肾上腺素是一种重要的神经递质,以石油裂解产物A和邻甲氧基苯酚为原料,经过中间体藜芦醛,合成去甲肾上腺素的路线如下所示。

已知:①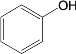
![]()
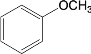
![]()

②![]()
![]()
![]() +
+![]()
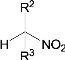
③![]() +
+
![]()
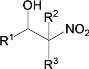
④D和F互为同分异构体。
回答下列问题:
(1)C → D的反应类型为__________,G → H的反应类型为__________;
(2)条件X为__________,E在条件X作用下发生变化的官能团名称为__________;
(3)关于上述合成,下列说法正确的是__________;(填序号)
a.1mol邻甲氧基苯酚能与3mol Br2发生取代反应
b.合成路线中CH3I和浓HI的作用是保护酚羟基不被O3氧化
c.藜芦醛分子中至少有14个原子共平面
d.1mol去甲肾上腺素熔化后至多可消耗3mol Na和2mol NaOH
(4)B + 邻甲氧基苯酚 → C的化学方程式为_______________________________;
(5)藜芦醛的同系物Y相对分子质量比藜芦醛大14,写出Y满足下列条件所有同分异构体的结构简式:
①能发生银镜反应;②1mol该有机物能消耗2mol NaOH(aq);③核磁共振氢谱有4组峰
__________________________________________________________;
(6)试设计以间苯二酚(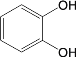 )为原料,制备聚酯
)为原料,制备聚酯 的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种邮寄材料中间体。实验室由芳香烃A制备H的一种合成路线如下:
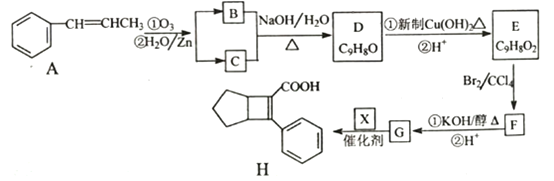
已知:①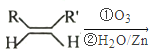 RCHO+RCHO
RCHO+RCHO
②RCHO+RCH2CHO![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香化合物B的名称为_________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由E生成F的反应类型为_________。
(3)X的结构简式为_________。
(4)写出D生成E的第①步反应的化学方程式_______________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有____种,写出其中任意一种的结构简式________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;
②其核磁共振氢谱显示有4种不同化学键环境的氢,且峰面积之比为6:2:1:1。
(6)写出用![]() 为原料制备化合物
为原料制备化合物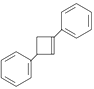 的合成路线,其他无机试剂任选。________
的合成路线,其他无机试剂任选。________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com