
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):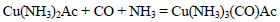
请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为 。
(2)写出基态Cu+的核外电子排布式 。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 。
(4)写出与CO互为等电子体的离子 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为 ;1 mol尿素分子中,σ键的数目为 。
(1)N>O>C (2)[Ar]3d10 (3)4 (4)CN- (5)sp2杂化、sp3杂化;4.214×1024
【解析】
试题分析:(1)一般来说非金属性越强,第一电离能大,所以O>N>C,但是因为p轨道半充满体系具有很强的稳定性,N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子,故答案为N>O>C(2)铜原子的核外电子排布为1s22s22p63s23p63d104s1 故一价铜离子的核外电子排布为1s22s22p63s23p63d10,故答案为[Ar]3d10(3)一价铜离子有三个氨基配体和一个羰基配体,共4个配体,故答案为4(4)等电子体为核外电子数相同的粒子,羰基为14个电子,如CN-也为14个电子,故答案为CN-(5)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2,中心原子为氮,氮原子含有3个共价键和一个孤电子对氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3;σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为 7NA故答案为sp2、sp3;7NA。
考点:物质的结构与性质之间的关系;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源:2014学年高一化学人教版必修2 1.3化学键练习卷(解析版) 题型:选择题
下列物质中,含共价键的离子化合物是( )。
A.MgCl2 B.N2 C.HCl D.Na2O2
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.2元素的性质与原子结构练习卷(解析版) 题型:填空题
(1)向NaBr和KI的混合溶液中,通入足量的Cl2后,将溶液蒸干并灼烧,最后蒸发皿中剩余的物质是________,写出反应的化学方程式:________________________________。
(2)向KI溶液中滴入淀粉溶液,现象是____________________,再滴入氯水,现象是________,有关反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.1元素周期表练习卷(解析版) 题型:选择题
第ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为
( )。
A.x-18 B.x-8 C.x+8 D.x+18
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.1元素周期表练习卷(解析版) 题型:选择题
我国的纳米技术基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的
( )。
A.第三周期ⅤA族 B.第四周期ⅢA族
C.第五周期ⅢA族 D.第四周期ⅤA族
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是

A.反应进行的前3 min内,用X表示的反应速率
B.平衡时容器内的压强为反应前的0.9倍
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮提分训练 专题1物质组成性质分类及化学用语练习卷(解析版) 题型:填空题
2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的________反应,该反应属于________(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。

图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为________________,D的化学式是________。
②A、B、E中均含有的一种元素符号为________。
③C与纯碱反应的化学方程式为____________________________________。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.反应A(g)  2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1
2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1
B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-)
C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲 乙
乙 丙。下列有关物质的推断不正确的是( )。
丙。下列有关物质的推断不正确的是( )。
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com