
”¾ĢāÄæ”æClO2ŹĒŅ»ÖÖɱ¾śŠ§ĀŹøß”¢¶ž“ĪĪŪČ¾Š”µÄĖ®“¦Ąķ¼Į”£ŹµŃéŹŅæÉŅŌĶعżŅŌĻĀ·“Ó¦ÖʵĆClO2£ŗ2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2+2H2O£¬
(1)Ė«ĻßĒűķŹ¾Ńõ»Æ»¹Ō£¬ĻßĒÅÉĻ±źĆ÷µĆŹ§µē×Ó”¢·¢ÉśµÄ·“Ó¦”£_______
(2)Čō1mo KClO3²Ī¼Ó·“Ó¦Ź±ÓŠ_______molµē×Ó×ŖŅĘ”£
(3)ČōÉś³É±ź×¼×“æöĻĀµÄCO2µÄĢå»żŹĒ44.8L£¬Ōņ²Ī¼Ó·“Ó¦µÄ»¹Ō¼ĮµÄĪļÖŹµÄĮæŹĒ¶ąÉŁmol£æ£ØŅŖĒóÓŠ¹ę·¶µÄ¹ż³Ģ£©_______”£
”¾“š°ø”æ 1 2
1 2
”¾½āĪö”æ
(1)øł¾ŻŌŖĖŲ»ÆŗĻ¼ŪÉż½µÓėµē×Ó×ŖŅĘÓė·“Ó¦ĄąŠĶµÄ¹ŲĻµ£¬ÓĆĖ«ĻßĒŷرķŹ¾µē×Ó×ŖŅĘ£»
(2)øł¾ŻŌŖĖŲ»ÆŗĻ¼Ū±ä»ÆŹżÄæµČÓŚ·“Ó¦¹ż³ĢÖŠµē×Ó×ŖŅĘŹżÄæ¼ĘĖć£»
(3)ĻČ¼ĘĖćCO2µÄĪļÖŹµÄĮ棬øł¾Ż·“Ó¦Ē°ŗóŌŖĖŲ»ÆŗĻ¼Ū±ä»ÆŹżÄæ¼ĘĖćµē×Ó×ŖŅĘ”£
(1)ŌŚ·“Ó¦2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2”ü+2H2OÖŠ£¬ClŌŖĖŲ»ÆŗĻ¼ŪÓÉ·“Ó¦Ē°KClO3ÖŠµÄ+5¼Ū±äĪŖ·“Ó¦ŗóClO2ÖŠµÄ+4¼Ū£¬»ÆŗĻ¼Ū½µµĶ£¬»ńµĆ2”Įe-£¬±»»¹Ō£»CŌŖĖŲ»ÆŗĻ¼ŪÓÉ·“Ó¦Ē°H2C2O4ÖŠµÄ+3¼Ū±äĪŖ·“Ó¦ŗóCO2ÖŠµÄ+4¼Ū£¬»ÆŗĻ¼ŪÉżøߣ¬Ź§Č„2”Įe-£¬±»Ńõ»Æ£¬ÓĆĖ«ĻßĒŷرķŹ¾µē×Ó×ŖŅĘĪŖ£ŗ £»
£»
(2)ŌŚøĆ·“Ó¦ÖŠClŌŖĖŲ»ÆŗĻ¼ŪÓÉ·“Ó¦Ē°KClO3ÖŠµÄ+5¼Ū±äĪŖ·“Ó¦ŗóClO2ÖŠµÄ+4¼Ū£¬»ÆŗĻ¼Ū½µµĶ1¼Ū£¬ĖµĆ÷1mol KClO3²Ī¼Ó·“Ó¦Ź±ÓŠ1molµē×Ó×ŖŅĘ”£
(3)n(CO2)=44.8L”Ā22.4L/mol=2mol£¬øł¾Ż·½³ĢŹ½æÉÖŖ£ŗĆæÓŠ1mol»¹Ō¼ĮH2C2O4·¢Éś·“Ó¦£¬»įĶ¬Ź±²śÉś2molCO2£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŹĒ2mol£¬ĻÖŌŚ·“Ó¦²śÉś2molCO2£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŹĒ2mol”£


 Ģį·Ö°Ł·Ö°Ł¼ģ²ā¾ķµ„ŌŖĘŚÄ©²āŹŌ¾ķĻµĮŠ“š°ø
Ģį·Ö°Ł·Ö°Ł¼ģ²ā¾ķµ„ŌŖĘŚÄ©²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĻĀĮŠ²Ł×÷ŗĶĻÖĻó£¬ĖłµĆ½įĀŪÕżČ·µÄŹĒ
Ń”Ļī | ²Ł×÷ŗĶĻÖĻó | ½įĀŪ |
A | ĘäĖūĢõ¼ž²»±ä£¬ĖõŠ”H2(g)+I2 (g) | Ōö“óŃ¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ |
B | ĻņÕįĢĒČÜŅŗÖŠ¼ÓČė¼øµĪĻ”ĮņĖį£¬Ė®Ō”¼ÓČČ¼ø·ÖÖÓ£¬ŌŁĻņĘäÖŠ¼ÓČėŠĀÖʵÄŅų°±ČÜŅŗ£¬²¢Ė®Ō”¼ÓČČ£»Ī“³öĻÖŅų¾µ | ÕįĢĒĪ“Ė®½ā |
C | Ļņµ°°×ÖŹČÜŅŗÖŠ¼ÓČėCuSO4ČÜŅŗŗĶNa2SO4±„ŗĶČÜŅŗ£¬¾ł²śÉś°×É«³Įµķ | µ°°×ÖŹ¾ł·¢ÉśĮĖ±äŠŌ |
D | ĘäĖūĢõ¼žĻąĶ¬Ź±£¬Na2S2O3ČÜŅŗŗĶĻ”H2SO4·“Ó¦£¬ÉżøßČÜŅŗµÄĪĀ¶Č£¬Īö³öĮņ³ĮµķĖłŠčŹ±¼äĖõ¶Ģ | µ±ĘäĖūĢõ¼ž²»±äŹ±£¬Éżøß·“Ó¦ĪĀ¶Č£¬»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ |
A. AB. BC. CD. D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°“ŅŖĒóĢīæÕ£ŗ
£Ø1£© ³żČ„KNO3ÖŠ»ģÓŠµÄSO42-ӦєŌńµÄ³żŌÓŹŌ¼ĮĪŖ__________£»
£Ø2£© Ļņ·ŠĢŚµÄÕōĮóĖ®ÖŠµĪ¼Ó±„ŗĶFeCl3ČÜŅŗæÉÖĘČ”Fe(OH)3½ŗĢ壬ÓĆ»Æѧ·½³ĢŹ½±ķŹ¾øĆ·½·ØµÄŌĄķ£ŗ_______£»
£Ø3£© ŌŚĖ®ČÜŅŗÖŠ£¬KHSO4µÄµēĄė·½³ĢŹ½ĪŖ£ŗ______________________________£»
£Ø4£© ŃĪĖįÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ__________________________£»
£Ø5£© CO2Óė×ćĮæ³ĪĒåŹÆ»ŅĖ®·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ__________________________£»
£Ø6£© ĮņĖįĶČÜŅŗÓėĒāŃõ»Æ±µČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ____________________ £»
£Ø7£©Š”ĖÕ“ņ³£×÷ĪŖŹ³Ę·ÖĘ×÷¹ż³ĢÖŠµÄÅņĖɼĮ£¬ĘäČÜŅŗÓėĻ”HNO3·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ___£»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ¢Ł4NH3£Øg£©+3O2£Øg£©=2N2£Øg£©+6H2O£Øg£©”÷H=©1269kJ/mol
¢Ś
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ¶ĻæŖ1 mol O©O¼ü±Č¶ĻæŖ1 mol N©N¼üĖłŠčÄÜĮæÉŁ448kJ
B. ¶ĻæŖ1 mol H©O¼ü±Č¶ĻæŖ1 mol H©N¼üĖłŠčÄÜĮæĻą²īŌ¼72.6kJ
C. ÓÉŅŌÉĻ¼üÄܵĊÅĻ¢æÉÖŖH2OµÄ·Šµć±ČNH3øß
D. ÓÉŌŖĖŲ·Ē½šŹōŠŌµÄĒæČõæÉÖŖ HŅ»O¼ü±ČHŅ»N¼üČõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬øı䷓ӦĪļÖŠn(SO2)¶Ō·“Ó¦2SO2£Øg£©+O2£Øg£©2SO3(g) ”÷H£¼0µÄÓ°ĻģČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
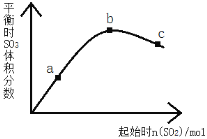
A. ·“Ó¦b”¢cµć¾łĪŖĘ½ŗāµć£¬aµćĪ““ļĘ½ŗāĒŅĻņÕż·“Ó¦·½Ļņ½ųŠŠ
B. a”¢b”¢cČżµćÖŠ£¬aµćŹ±SO2µÄ×Ŗ»ÆĀŹ×īøß
C. ÉĻŹöĶ¼ĻóæÉŅŌµĆ³öSO2µÄŗ¬ĮæŌ½øߵƵ½µÄ»ģŗĻĘųĢåÖŠSO3µÄĢå»ż·ÖŹżŌ½øß
D. a”¢b”¢cČżµćµÄĘ½ŗā³£ŹżKb£¾Kc£¾Ka
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ×”¢Įņ”¢ĀČ”¢ÉéµČŹĒÅ©Ņ©ÖŠµÄÖŲŅŖ×é³ÉŌŖĖŲ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©»łĢ¬ÉéŌ×ÓµÄŗĖĶā¼Ūµē×ÓÅŲ¼Ź½ĪŖ___________”£
£Ø2£©Éś²śÅ©Ņ©µÄŌĮĻPSCl3ÖŠP”¢S”¢ClµÄµŚŅ»µēĄėÄÜÓɓ󵽊”µÄĖ³ŠņĪŖ________£¬µēøŗŠŌÓɓ󵽊”µÄĖ³ŠņĪŖ________________________”£
£Ø3£©H2O ÓėH2SĪŖĶ¬×åŌŖĖŲµÄĒā»ÆĪļ£¬H2OæÉŅŌŠĪ³ÉH3O+»ņH9O4+µČ£¬¶ųH2S¼øŗõ²»ÄÜŠĪ³ÉĄąĖʵÄH3S+»ņH9S4+£¬ĘäŌŅņŹĒ______________________”£
£Ø4£©COS£ØōŹ»łĮņ£©æÉÓĆ×÷ĮøŹ³µÄѬÕō¼Į£¬ĘäÖŠĢ¼Ō×ÓµÄŌӻƹģµĄĄąŠĶĪŖ_____________£¬Ėłŗ¬¹²¼Ū¼üµÄĄąŠĶĪŖ_____________£¬N2OÓėCO2»„ĪŖµČµē×ÓĢ壬ĒŅN2O·Ö×ÓÖŠOÖ»ÓėŅ»øöNĻąĮ¬£¬ŌņN2OµÄµē×ÓŹ½ĪŖ_____________________”£
£Ø5£©AlPŅņɱ³ęŠ§ĀŹøß”¢Į®¼ŪŅ׵ƶų±»¹ć·ŗÓ¦ÓĆ”£ŅŃÖŖAlPµÄČŪµćĪŖ2000”ę £¬Ę侧°ū½į¹¹ČēĶ¼ĖłŹ¾”£
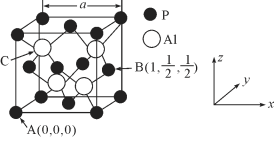
¢ŁĮ×»ÆĀĮµÄ¾§ĢåĄąŠĶĪŖ_____________”£
¢ŚA”¢BµćµÄŌ×Ó×ų±źČēĶ¼ĖłŹ¾£¬ŌņCµćµÄŌ×Ó×ų±źĪŖ_____________”£
¢ŪĮ×»ÆĀĮµÄ¾§°ū²ĪŹża£½546.35pm£¬ĘäĆܶČĪŖ_____________£ØĮŠ³ö¼ĘĖćŹ½¼“æÉ£¬ÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄŹżÖµ£©g/cm3”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃõ»Æ»¹Ō·“Ó¦ÓėĖÄÖÖ»ł±¾ĄąŠĶ·“Ó¦µÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬ŌņĻĀĮŠ»Æѧ·“Ó¦ŹōÓŚĶ¼ÖŠŅõÓ°²æ·ÖµÄŹĒ£Ø £©
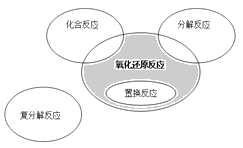
A.4Fe(OH)2+O2+2H2O== Fe(OH)3
B.2NaHCO3![]() Na2CO3+H2O+CO2ӟ
Na2CO3+H2O+CO2ӟ
C.4NH3+5O2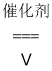 4NO+6H2O
4NO+6H2O
D.Zn+H2SO4=ZnSO4+H2ӟ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)3-¼×»ł-2-ĪģĻ©µÄ½į¹¹¼ņŹ½ĪŖ______________£»
(2)ijĢžµÄ·Ö×ÓŹ½ĪŖC4H4£¬ĖüŹĒŗĻ³ÉĻš½ŗµÄÖŠ¼äĢ壬ĖüÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ唣
¢ŁŠ“³öĖüµÄŅ»ÖÖĮ“Ź½½į¹¹µÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½(ĢįŹ¾£ŗĶ¬Ņ»øöĢ¼Ō×ÓÉĻĮ¬½Ó2øöĢ¼Ģ¼Ė«¼üµÄ½į¹¹²»ĪȶØ)______________£»
¢ŚĖüÓŠŅ»ÖÖĶ¬·ÖŅģ¹¹Ģ壬ĆæøöĢ¼Ō×Ó¾ł“ļ±„ŗĶ£¬ĒŅĢ¼ÓėĢ¼µÄ¼Š½ĒĻąĶ¬£¬øĆ·Ö×ÓÖŠĢ¼Ō×ÓŠĪ³ÉµÄæռ乹ŠĶĪŖ______________ŠĪ”£
(3)½«ÓŠ»śĪļAÖĆÓŚŃõĘųĮ÷ÖŠ³ä·ÖČ¼ÉÕ£¬ŹµŃé²āµĆ£ŗÉś³É5.4g H2OŗĶ8.8g CO2£¬ĻūŗÄŃõĘų6.72L(±ź×¼×“æöĻĀ)£¬ŌņøĆĪļÖŹµÄŹµŃéŹ½ŹĒ__________£»
(4)Š“³öÓɼױ½ÖĘTNTµÄ·½³ĢŹ½_________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ4ÖÖĢ¼¼ÜČēĻĀµÄĢž£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ( )
¢Ł ![]() ŗĶ
ŗĶ![]() ŹĒĶ¬·ÖŅģ¹¹Ģå ¢Ś
ŹĒĶ¬·ÖŅģ¹¹Ģå ¢Ś ![]() ŗĶ
ŗĶ![]() ŹĒĶ¬ĻµĪļ
ŹĒĶ¬ĻµĪļ
¢Ū ![]() ŗĶ
ŗĶ![]() ¶¼ÄÜ·¢Éś¼Ó³É·“Ó¦ ¢Ü
¶¼ÄÜ·¢Éś¼Ó³É·“Ó¦ ¢Ü![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
”¢![]() ¶¼ÄÜ·¢ÉśČ”“ś·“Ó¦
¶¼ÄÜ·¢ÉśČ”“ś·“Ó¦
A. ¢Ł¢ÜB. ¢Ł¢ŚC. ¢Ł¢Ś¢ŪD. ¢Ł¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com