
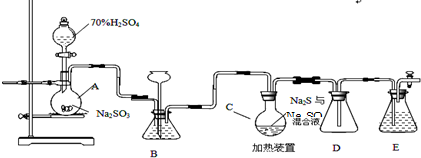
分析 本题利用含硫废水生产Na2S2O3•5H2O的工业流程探究,涉及实验操作的分析,主要包括利用液差法检验气密性、并利用装置D防止倒吸及尾气用氢氧化钠溶液吸收,还包括SO42-的检验方法,据此分析解题;
(1)液柱高度保持不变,说明气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(2)观察SO2的生成速率,发生强酸制取弱酸的反应,Ⅲ中发生S(g)+Na2SO3(aq)$\frac{\underline{\;加热\;}}{\;}$Na2S2O3(aq),反应达到终点是S完全溶解,烧杯、锥形瓶需要加热时必须使用石棉网,蒸发皿、试管可直接加热;
(3)检测产品中是否存在Na2SO4,先加盐酸排除干扰,再利用氯化钡检验硫酸根离子.
解答 解:利用含硫废水生产Na2S2O3•5H2O的工业流程探究,涉及实验操作的分析,主要包括利用液差法检验气密性、并利用装置D防止倒吸及尾气用氢氧化钠溶液吸收,还包括SO42-的检验方法,据此分析解题;
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)观察SO2的生成速率,发生强酸制取弱酸的反应,a不生成二氧化硫,bd中物质均与二氧化硫反应,只有c中饱和NaHSO3溶液适合制取二氧化硫;Ⅲ中发生S(g)+Na2SO3(aq)$\frac{\underline{\;加热\;}}{\;}$Na2S2O3(aq),反应达到终点是S完全溶解,可观察到溶液变澄清(或浑浊消失);烧杯、锥形瓶需要加热时必须使用石棉网,
故答案为:c;控制滴加硫酸的速度;溶液变澄清(或浑浊消失);ad
(3)检测产品中是否存在Na2SO4,操作、现象和结论为取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质.
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价、化学计算等,侧重实验分析能力及知识综合应用能力的考查,(2)为易错点,可以利用总反应的分析,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工艺流程如图.
工艺流程如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com