
| A、1:1:1 |
| B、6:2:3 |
| C、4:3:18 |
| D、2:1:3 |
| n |
| V |
| 2 |
| 3 |
| 1 |
| 2 |
| 3 |
| 1 |


科目:高中化学 来源: 题型:
| A、用漂白粉消毒游泳池中的水 |
| B、用醋酸除去热水瓶胆壁上的水垢 |
| C、用食盐腌渍食物 |
| D、用小苏打治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水应密封避光保存 |
| B、硅酸钠溶液保存在带有玻璃塞的试剂瓶中 |
| C、少量的金属钠应保存在煤油中 |
| D、氢氧化钠固体可以保存在塑料瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaOH溶液中通入过量的CO2气体:CO2+2OH-=HCO3-+H2O |
| B、将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、Fe3O4与稀硝酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D、偏铝酸钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、稀硝酸与过量的铁屑反应 3Fe+8H++2NO3─=3Fe2++2NO↑+4H2O |
| D、等体积、等物质的量浓度的NaHSO4与Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.045mol?L-1 |
| B、1mol?L-1 |
| C、0.029mol?L-1 |
| D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:K+、Na+、MnO4-、SO42- |
| B、c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
| C、由水电离出的c(OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| D、能使甲基橙变黄色的溶液中:Na+、NO3-、S2-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
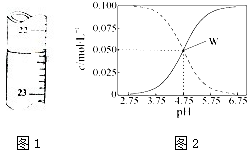 (1)用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图1所示,此时的读数为
(1)用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图1所示,此时的读数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com