
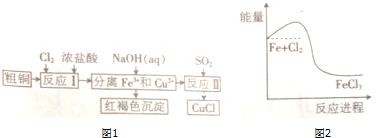
 .
.分析 粗铜含有Fe、Cu,通入氯气,生成FeCl3、CuCl2,加入氢氧化钠调节pH,可生成Fe(OH)3红褐色沉淀,过滤后在溶液中通入二氧化硫,发生氧化还原反应生成CuCl,
(1)氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;
(2)氯气与铁反应生成氯化铁,反应物总能量大于生成物总能量,为放热反应;
(3)增大固体表面积,可增大反应速率;
(4)溶液2含有CuCl2,通入一定量的SO2,生成沉淀CuCl,发生氧化还原反应,SO2为还原剂,被氧化为SO42?;结合v=$\frac{△c}{△t}$计算.
解答 解:粗铜含有Fe、Cu,通入氯气,生成FeCl3、CuCl2,加入氢氧化钠调节pH,可生成Fe(OH)3红褐色沉淀,过滤后在溶液中通入二氧化硫,发生氧化还原反应生成CuCl,
(1)氯气分子中存在1个Cl-Cl共用电子对,氯气分子的电子式为: ,
,
故答案为: ;
;
(2)氯气与铁反应生成氯化铁,反应的方程式为2Fe+3Cl2=2FeCl3,反应物总能量大于生成物总能量,为放热反应,故答案为:2Fe+3Cl2=2FeCl3;放热;
(3)在反应I中,要粉碎粗铜,可增大固体表面积,增大反应速率,故答案为:增大反应速率;
(4)溶液2含有CuCl2,通入一定量的SO2,生成沉淀CuCl,发生氧化还原反应,SO2为还原剂,被氧化为SO42?,反应离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-,若反应Ⅱ中c(Cu2+)由2mol•L-1变到1mol•L-1,则在这段时间内v(Cu2+)=$\frac{2mol/L-1mol/L}{5min}$=0.2mol/(L•min),
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;0.2mol/(L•min).
点评 本题考查物质的制备实验方案、化学工艺流程,为高考常见题型,题目综合考查元素化合物、化学反应原理以及实验操作等问题,侧重于基础知识的综合应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C4H6 | B. | C2H6 | C. | C6H6 | D. | C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
-C═C- | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |
| 碳碳双键 | 碳碳三键 | 甲基 | 乙基 | 羟基 | 醛基 | 羧基 | 酯键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由a形成的单质的熔点都很高 | |
| B. | 各元素的最高化合价的顺序为:c<a=d<b | |
| C. | b分别与a、d均能形成共价化合物 | |
| D. | c的氢化物的还原性比b的氢化物弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
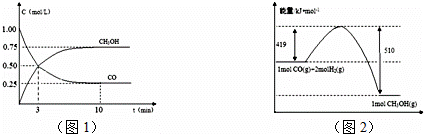
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水、稀豆浆、蔗糖水都能产生丁达尔效应 | |
| B. | “玉兔”月球车太阳能电池帆板的主要材料是二氧化硅 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | 黑火药含有硫磺、硝酸钾和木炭,其中硝酸钾是电解质,硫磺和木炭是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
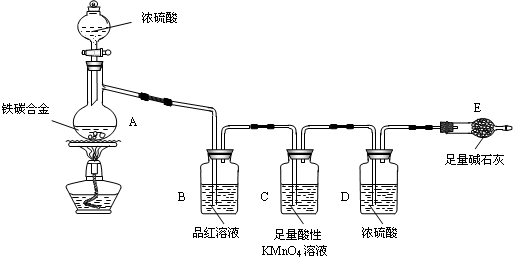
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com