
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)根据溶液呈电中性的原理可得:c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-),将各个数值代入上述式子可得c(H+),再根据pH=-lgc(H+)计算;
(2)①:Ⅰ.2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
Ⅱ.2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
根据盖斯定律(Ⅱ-Ⅰ)×$\frac{1}{2}$可得;
②能吸收二氧化硫,和二氧化硫发生反应的试剂可以吸收;
(3)①i.计算平衡物质的量,反应前后气体的体积不变,可以用物质的量代替浓度计算平衡常数,则该温度下的平衡常数K=$\frac{{c}^{2}(NO)}{c({N}_{2})c({O}_{2})}$;
ii.A.混合气体总质量不变,容器容积不变,混合气体的密度为定值;
B.混合气体总质量不变,混合气体总物质的量不变,混合气体的平均分子量为定值;
C. 平衡时各组分物质的量关系,与起始物质的量及转化率有关;
D.氧气的百分含量不在变化,说明反应到达平衡;
iii.正反应为吸热反应,若升高温度,则平衡正向移动,反应速率增大;
②依据反应自发进行的判断依据是△G=△H-T•△S<0分析;
(4)应减少二氧化硫、氮的氧化物等排放;
解答 解:(1)由电荷守恒可知,c(K+)+c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(Cl-)+2c(SO42-)+c(NO3-),则c(H+)-c(OH-)=(2×10-5+2×4×10-5+3×10-5-4×10-6-6×10-6-2×10-5)mol/L=10-4mol/L,溶液呈酸性,溶液中H+离子浓度约是为10-4,pH值=-lgc(H+)=4,
故答案为:4;
(2)①已知:Ⅰ.2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
Ⅱ.2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
根据盖斯定律,(Ⅱ-Ⅰ)×$\frac{1}{2}$可得:C(s)+H2O(g)=H2(g)+CO(g),△H=[-221.0kJ•mol-1-(-483.6kJ•mol-1)]÷2=+131.3kJ•mol-1,
故答案为:+131.3;
②A.可以发生反应:Ca(OH)2+SO2=CaSO3↓+H2O,故A正确;
B.可以发生反应:Na2CO3+SO2=Na2SO3+CO2,故B正确;
C.CaCl2与SO2不反应,不能作吸收剂,故C错误;
D.NaHSO3与SO2不反应,不能作吸收剂,故D错误,
故答案为:AB;
(3)①i.在反应开始时,n(N2)=0.8mol;n(O2)=0.2mol,n(NO)=0;当反应达到平衡时,n(N2)=(0.8-4×10-4)mol,n(O2)=(0.2-4×10-4)mol,n(NO)=8×10-4mol,反应前后气体的体积不变,可以用物质的量代替浓度计算平衡常数,则该温度下的平衡常数K=$\frac{{c}^{2}(NO)}{c({N}_{2})c({O}_{2})}$=$\frac{(8×1{0}^{-4})^{2}}{(0.8-4×1{0}^{-4})(0.2-4×1{0}^{-4})}$=4×10-6,
故答案为:4×10-6;
ii.A.混合气体总质量不变,容器容积不变,混合气体的密度为定值,故A错误;
B.混合气体总质量不变,混合气体总物质的量不变,混合气体的平均分子量为定值,故B错误;
C. 平衡时各组分物质的量关系,与起始物质的量及转化率有关,不一定等于化学计量数之比,故C错误;
D.氧气的百分含量不在变化,说明反应到达平衡,故D正确,
故选D,
故答案为:D;
ⅲ.正反应为吸热反应,若升高温度,则平衡正向,逆反应速率变大,
故答案为:正向;变大;
②由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应,△H>0,△S<0,故体系的△G=△H-T•△S>0,所以该设想不能实现,
故答案为:不能;
(4)应减少二氧化硫、氮的氧化物等排放,措施为:燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器,
故答案为:燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
点评 本题考查了热化学方程式书写、影响化学反应速率、化学平衡的因素分析、平衡常数计算、反应自发进行的判断依据等知识点,掌握基础是解题关键,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 含乙酸钠和对氯酚(
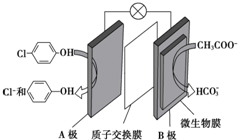
含乙酸钠和对氯酚(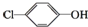 )的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| D. | 处理后的废水pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
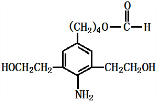
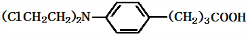
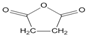 ),试剂③是环氧乙烷(
),试剂③是环氧乙烷(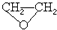 ),且环氧乙烷在酸或碱中易水解或聚合.
),且环氧乙烷在酸或碱中易水解或聚合.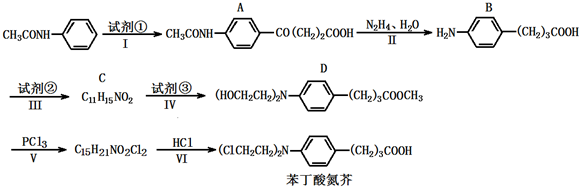
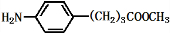
 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$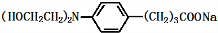 +2NaCl+H2O
+2NaCl+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
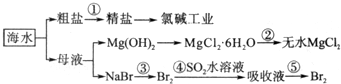
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
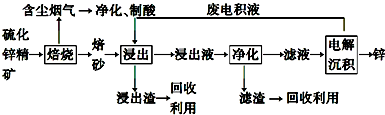
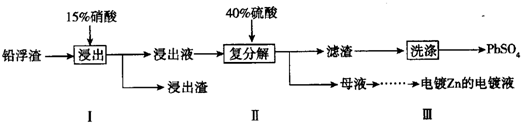
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精是用淀粉类植物经过发酵后蒸馏制得,浓度通常是75% | |
| B. | 为防止电池中的重金属污染土壤和水体,应将废电池深埋 | |
| C. | “海水淡化”可以解決“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 小苏打是制作面包等糕点的膨松剂.也是胃溃疡病人的治疗药物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com