


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:不详 题型:单选题
| A.只有不需要任何条件就能够自动进行的过程才是自发过程 |
| B.需要加热才能够进行肯定不是自发过程 |
| C.同一可逆反应的正逆反应在不同的条件下都有自发反应的可能 |
| D.非自发过程在任何条件下都不可能变为自发过程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
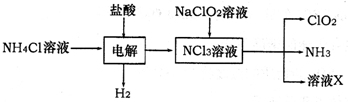
| ||
| . |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 1 |
| 2 |
| 1 |
| 2 |
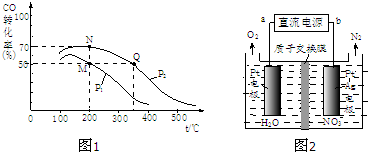
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两者对应反应的△H均小于0 |
| B.两者的单位均为kJ/mol,但mol-1的含义不同 |
| C.两者的数值均不随反应物用量改变而改变 |
| D.两者的数值均随反应物改变而改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.7 | B.12.3 | C.12 | D.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com