

科目:高中化学 来源: 题型:
a-
| ||
| a |
a-
| ||
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:填空题
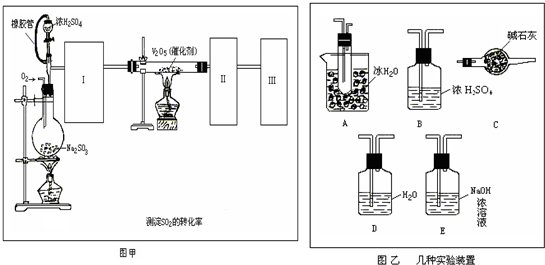
I.目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是_____________ 该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
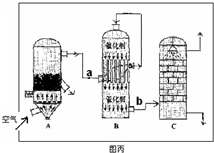
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为 。
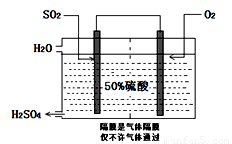
II. 纯碱是一种重要的化工原料。目前制碱工业主要有 “氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式: ;
(2)写出“联合制碱法”有关反应的化学方程式: ;
。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,
“氨碱法”中CO2来源于 ;
查看答案和解析>>
科目:高中化学 来源:2010年四川省高三考前适应训练(理科综合)化学部分 题型:实验题
(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
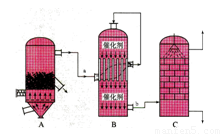
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。

①试管b中得到的主要产物是 ,检验该产物的方法是(结合离子方程式简要说明) 。
②为检验反应的另一种生成物,试管c中应加入的试剂是 ,简述相应的实验现象及结论 。
③ 所得硫酸的理论浓度(溶质的质量分数)为 。
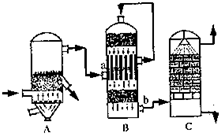
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:

①图中设备A的名称是 ,a、b两处所含气体的化学式分别为 、 。
②有关接触法制硫酸的下列说法中,不正确的是 。
A. 二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:① 生产成本低、② 原料易得、③ 、④ 、⑤ 、⑥ (可不填满)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com