
【题目】工业上制硫酸的一步重要反应是2SO2(g)+O2(g)![]() 2SO3(g),此反应在某条件下的某密闭反应容器中达到化学平衡状态。下列有关说法不正确的是( )
2SO3(g),此反应在某条件下的某密闭反应容器中达到化学平衡状态。下列有关说法不正确的是( )
A.此时,SO2的转化率达到最大程度
B.此时,SO2的消耗速率等于SO2的生成速率
C.此时,SO3的浓度保持不变
D.该反应达到化学平衡状态后反应停止
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是
A. O2和O3
B. CH3CH3和CH2=CH2
C. ![]() 和
和
D. CH3CH2CH2CH2 CH3和(CH3)2CH CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
(1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为__________。
(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为ZnO+C![]() Zn+CO↑,此法为_____。
Zn+CO↑,此法为_____。
A 电解法 B 热还原法 C 热分解法
(3)可用石墨作电极电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图所示。
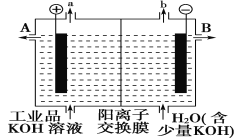
①该电解池的阳极,阴极反应式为阳极:_________阴极:________
②除去杂质后的氢氧化钾溶液从出口________(填“A”或“B”)导出。
③在相同条件下,a处与b处产生的气体体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.NaOH溶液与稀硫酸反应:OH-+H+=H2O
C.铁片和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.石灰石与硝酸反应:C![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为![]() 的
的![]() 溶液和
溶液和![]() 溶液按体积分别为Va和Vb混合,保持
溶液按体积分别为Va和Vb混合,保持![]() ,且生成的
,且生成的![]() 可溶于水。已知
可溶于水。已知![]() 与混合液pH关系如图。下列说法错误的是( )
与混合液pH关系如图。下列说法错误的是( )
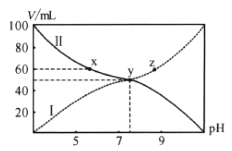
A.曲线Ⅰ表示![]() 溶液体积B.
溶液体积B.![]() 点存在
点存在![]()
C.电离平衡常数![]() D.向
D.向![]() 点溶液加入
点溶液加入![]() ,水的电离程度减小
,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
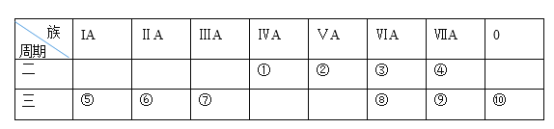
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是________________________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),
(3)这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(4)⑤、⑧两种元素的最高价氧化物对应的水化物相互反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是( )
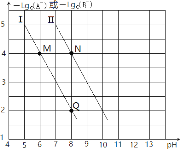
A.曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.![]() =1000
=1000
C.溶液中水的电离程度:M>N
D.N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、铜及其化合物在工业上有重要用途,回答下列问题:
(1) 请补充完基态Co的简化电子排布式:[Ar]______, Co2+有________个未成对电子。
(2)Na3[Co(NO2)6]常用作检验K+的试剂, 配位体![]() 的中心原子的杂化形式为______, 空间构型为______。大π键可用符号
的中心原子的杂化形式为______, 空间构型为______。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ,则
,则![]() 中大π键应表示为________。
中大π键应表示为________。
(3)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是__________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是___________
(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为________,铜原子的半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为________ g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质](15分)
锌是人体必需的微量元素之一,起着极其重要的作用,回答下列问题:
(1)请写出Zn2+的核外电子排布式_____________________。
(2)ZnCl2熔点为275 ℃,而CaCl2的熔点为782 ℃,请分析熔点不同的原因:_________。
(3)Zn2+能与多种微粒形成配合物,如Zn2+与CNO可形成[Zn(CNO)4]2,[Zn(CNO)4]2中配位原子为__________,[Zn(CNO)4]2的组成中非金属元素的电负性大小顺序为____________;Zn2+与CN可形成[Zn(CN)4]2,[Zn(CN)4]2中σ键、π键和配位键的个数比为________;配合物Zn(NH3)4CO3中阴离子的空间构型为____________,N原子的杂化方式为____________。
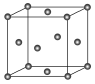
(4)Zn与S所形成化合物的晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图:
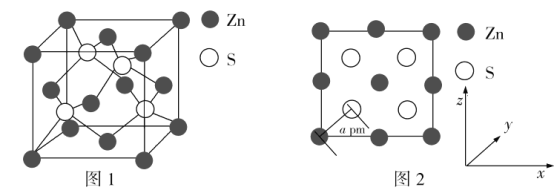
①晶胞中S原子的配位数为_________。
②晶胞中最近的两个S原子之间的距离为_______pm。
③设阿伏加德罗常数的值为NA,则该晶胞的密度是__________g·cm3(列出计算表达式)。
[化学——选修5:有机化学基础](15分)
哌替啶盐酸盐G有镇痛作用,其合成路线如下。回答下列问题:
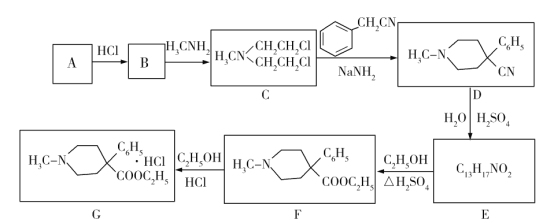
(1)写出A的结构简式:________;B中含有碳碳双键,则B的名称为_____________。
(2)G中含氧官能团名称为____________;B→C的反应类型为_________________。
(3)E的结构简式为_____________。
(4)写出C→D的化学方程式:_______________________________________。
(5)M与E互为同分异构体,符合下列条件的M有______种。
①属于芳香α-氨基酸;
②含有两个六元环。
其中一种同分异构体,—NH2被H原子取代后,除苯基上H原子外,其他核磁共振氢谱的峰面积比为4∶4∶1∶1∶1,该同分异构体的结构简式为______________。
(6)请结合以上合成路线,写出以H3CNHCH2Cl和CH2=CHCl及上述流程中出现的物质为原料合成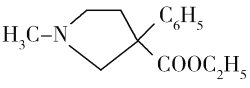 的路线______________________。
的路线______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com