
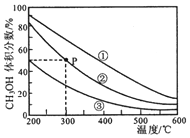
| A. | 该反应的正反应为放热反应 | |
| B. | 三个容器容积:①>②>③ | |
| C. | 在P点,CO转化率为75% | |
| D. | 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
分析 A.同一容器中,升高温度,甲醇的体积分数减小,说明升高温度平衡逆向移动;
B.相同温度下,增大压强(缩小容器容积)平衡正向移动,则甲醇的体积分数增大;
C.P点,容器中甲醇的体积分数是50%,同一容器中气体的体积分数等于其物质的量分数,
设此时CO的转化率为x,
该反应中CO(g)+2H2(g)?CH3OH(g)
开始(mol)0.1 0.2 0
反应(mol)0.1x 0.2x 0.1x2
平衡(mol)0.1(1-x) 0.2(1-x) 0.1x
甲醇的体积分数=$\frac{0.1x}{0.1(1-x)+0.2(1-x)+0.1x}$×100%=50%
x=0.75
D.设容器体积为VL,P点化学平衡常数K=$\frac{\frac{0.1×0.75}{V}}{\frac{0.1×0.25}{V}×(\frac{0.2×0.25}{V})^{2}}$=1200V2,
向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时浓度商=$\frac{\frac{0.1×0.75+0.025}{V}}{\frac{0.1×0.25+0.025}{V}×(\frac{0.2×0.25+0.025}{V})^{2}}$
=355.5V2<K.
解答 解:A.同一容器中,升高温度,甲醇的体积分数减小,说明升高温度平衡逆向移动,则正反应是放热反应,故A正确;
B.相同温度下,增大压强(缩小容器容积)平衡正向移动,则甲醇的体积分数增大,根据图知,甲醇的体积分数大小顺序是:①>②>③,说明压强大小顺序是:①>②>③,则容器体积为:①<②<③,故B错误;
C.P点,容器中甲醇的体积分数是50%,同一容器中气体的体积分数等于其物质的量分数,
设此时CO的转化率为x,
该反应中CO(g)+2H2(g)?CH3OH(g)
开始(mol)0.1 0.2 0
反应(mol)0.1x 0.2x 0.1x2
平衡(mol)0.1(1-x) 0.2(1-x) 0.1x
甲醇的体积分数=$\frac{0.1x}{0.1(1-x)+0.2(1-x)+0.1x}$×100%=50%
x=0.75,则CO的转化率为75%,故C正确;
D.设容器体积为VL,P点化学平衡常数K=$\frac{\frac{0.1×0.75}{V}}{\frac{0.1×0.25}{V}×(\frac{0.2×0.25}{V})^{2}}$=1200V2,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时浓度商=$\frac{\frac{0.1×0.75+0.025}{V}}{\frac{0.1×0.25+0.025}{V}×(\frac{0.2×0.25+0.025}{V})^{2}}$=355.5V2<K,说明平衡正向移动,则此时 v(CO)正>v (CO)逆,故D错误;
故选AC.
点评 本题考查化学平衡计算及图象分析,为高频考点,侧重考查学生分析判断、计算能力,明确温度、压强对化学平衡影响是解本题关键,注意D中反应方向判断方法,知道化学平衡常数计算方法,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠:供氧剂 | B. | 碱石灰:干燥剂 | ||
| C. | 小苏打:发酵粉主要成分 | D. | 纯碱:治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | X和Y形成的原子个数比为1:1的分子中极性键和非极性键之比为2:1 | |
| C. | Z元素在自然界中存在游离态 | |
| D. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.16mol/L | C. | 0.08mol/L | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 9种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| B. | 为防止食品氧化,常在食品袋中放入装有CaO的透气小袋 | |
| C. | 油脂在人体内水解为氨基酸和甘油等小分子被吸收 | |
| D. | 生产有机玻璃的主要原料为纯碱、石英和石灰石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com