
| A. | 步骤①中当v正(CrO42-)=2v逆(Cr2O72-)时,说明反应:2CrO42-+2H+?Cr2O72-+H2O 达到平衡状态 | |
| B. | 若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 | |
| C. | 步骤②中,若要还原1 mol Cr2O72-离子,需要12 mol (NH4)2Fe(SO4)2 | |
| D. | 步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全) |
分析 A.正逆反应速率相等时达到平衡状态;
B.根据CrO42-(黄色)$→_{①转化}^{H+}$Cr2O72-(橙色)分析;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至5时,c(OH-)=10-9mol/L,结合Ksp计算c(Cr3+).
解答 解:A.步骤①中当v正(CrO42-)=2v逆(Cr2O72-)时,说明正逆反应速率相等,各组分浓度不再变化,则反应2CrO42-+2H+?Cr2O72-+H2O 达到平衡状态,故A正确;
B.CrO42-(黄色)$→_{①转化}^{H+}$Cr2O72-(橙色),则碱性条件下,Cr2O72-(橙色)会转化成CrO42-(黄色),溶液可由橙色变黄色,故B正确;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2•6H2O,故C错误;
D.步骤③中,当将溶液的pH调节至5时,c(OH-)=10-9mol/L,由Ksp可知,c(Cr3+)=$\frac{1{0}^{-32}}{({1{0}^{-9})}^{3}}$=10-5mol/L,则可认为废水中的铬元素已经除尽,故D正确;
故选C.
点评 本题考查化学平衡的影响因素、难溶物溶解平衡及其应用,题目难度中等,涉及化学平衡状态判断、平衡移动、氧化还原反应中电子转移的计算及溶解度计算等知识,注重学生知识迁移应用能力的考查.


科目:高中化学 来源: 题型:选择题
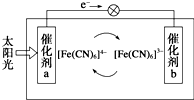 一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A. | K+移向催化剂b | |
| B. | 催化剂a表面发生的化学反应:[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| C. | Fe(CN)63-在催化剂b表面被氧化 | |
| D. | 电解池溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与溴水(加成反应) | |
| B. | 苯与浓硝酸(取代反应) | |
| C. | 乙醇与乙酸(酯化反应) | |
| D. | 乙醇与氧气在铜作催化剂下反应(取代反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 适宜条件下,SO2和O2可以完全转化为SO3 | |
| B. | 反应达到平衡后正逆反应的速率皆为零 | |
| C. | 若用18O2进行反应,达到平衡时二氧化硫中也会有18O | |
| D. | 工业合成SO3时,既要考虑反应速率也要考虑反应限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.
,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com