
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
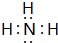 ,①④⑤三种元素形成的最简单一种化合物为NaOH,含有离子键、共价键,故答案为:
,①④⑤三种元素形成的最简单一种化合物为NaOH,含有离子键、共价键,故答案为: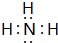 ;离子键、共价键.
;离子键、共价键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Mg的质量 | 酸量 | 开始的反应速率 | 产生 H2总量 | |
| Ⅰ | 0.24g | HC1 0.2mol/L100mL | v1 | n1 |
| Ⅱ | 0.24g | CH3COOH 0.2mol/L100mL | v2 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
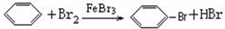
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢气还原氧化铜时,通入氢气立即给氧化铜加热,实验结束,撤掉氢气后停止加热 |
| B、点燃氢气前一定要检验氢气的纯度 |
| C、制取氧气实验结束时,先移去酒精灯,再把导管从水槽中取出 |
| D、皮肤上沾上浓硫酸,立即用氢氧化钠中和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com