
| Kw |
| c(OH-) |
| c(H+)?c(A-) |
| c(HA) |
| x2 |
| 1-x |
| Kw |
| c(OH-) |
| 9×10 -14 |
| 5.0×10 -5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、氧化铁能与酸反应,可用于制作红色涂料 |
| B、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂在酸性条件下水解可得高级脂肪酸和丙醇 |
| B、葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
| C、可利用紫色石磊试液来鉴别苯、溴苯和乙醇 |
| D、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同浓度、同体积的NaOH和氨水溶液中,水的电离程度相同 |
| B、升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性 |
| C、向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低 |
| D、向水中加入少量硫酸,c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
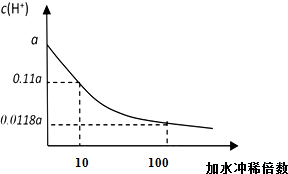 某HA的稀溶液,其浓度为b mol/L,在稀释过程中的c(H+)变化如图所示.
某HA的稀溶液,其浓度为b mol/L,在稀释过程中的c(H+)变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中的能量变化都表现为热量变化 |
| B、需要加热才能发生的反应不一定是吸热反应 |
| C、向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的 |
| D、反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com