
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是

A.原子半径:W<X<Y
B.元素的非金属性:Z>Y>X
C.化合物XZ2中所有原子均满足8电子稳定结构
D.X、 Z的单质分别直接与Y的单质反应,都能生成两种氧化物。
【答案】C
【解析】
0.05mol/L丙溶液的pH为l,可知丙为二元强酸,应为H2SO4,K是无色气体,是主要的大气污染物之一,且可生成H2SO4,则应为SO2,可知乙为O2,L为H2O,乙是常见的气体,且与浓硫酸和甲反应生成,可知甲为C,M为CO2,则W为H元素,X为C元素,Y为O元素,Z为S元素,以此解答该题。
由题意分析可知,W为H元素,X为C元素,Y为O元素,Z为S元素,
A.同周期元素原子半径从左到右逐渐减小,电子层越多原子半径越大,则原子半径为C>O>H,即W<Y<X,故A错误;
B.同主族元素从上到下非金属性减弱,且碳酸的酸性小于硫酸,可知非金属性为O>S>C,即Y>Z>X,故B错误;
C.X为C元素,Z为S元素,化合物XZ2为CS2,电子式为![]() ,其中所有原子均满足8电子稳定结构,故C正确;
,其中所有原子均满足8电子稳定结构,故C正确;
D.X为C元素,Z为S元素,Y为O元素,C与氧气反应可生成CO和CO2,S与氧气反应只能生成SO2,故D错误;
答案选C。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是( )
A.体积大小: ④>③>②>①B.原子数目: ③>①>④>②
C.密度大小: ④>②>③>①D.质量大小: ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________________________,Y元素原子最外层电子的电子排布图为:____________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________形,中心原子的轨道杂化类型为__________,分子为______________(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________。
(5)该化合物的沸点与SiCl4比较:________(填化学式)的高,原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() +HNO3
+HNO3![]() +H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
+H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
A.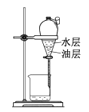 分液B.
分液B.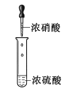 配制混酸
配制混酸
C.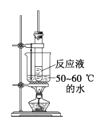 水浴加热D.
水浴加热D.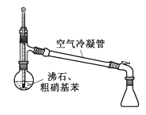 蒸馏提纯
蒸馏提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
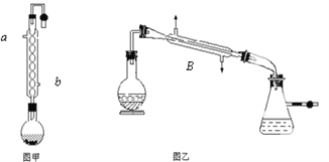
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
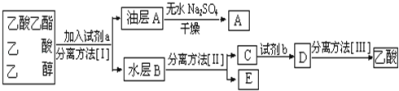
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。

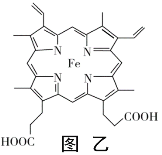
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________


(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)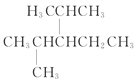 名称为:________________________________
名称为:________________________________
(4)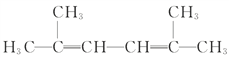 名称为:_______________
名称为:_______________
(5)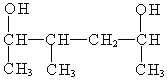 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温常压下,18g甲烷(14CH4)所含的中子数为9NA
B.25℃时,pH=7的纯水中含OH-的数目为10-7NA
C.铜与浓硝酸反应生成NO2、N2O4共23g,则铜失去的电子数为0.5NA
D.密闭容器中2mol NO与1mol O2充分反应,所得产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应:![]() 并达到平衡。
并达到平衡。
(1)平衡后,向容器中充入1mol![]() ,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)______判断该反应达已经到平衡状态。若初始时加入的![]() 为2.84g,10分钟后达到平衡时
为2.84g,10分钟后达到平衡时![]() 的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,
的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,![]() ________。
________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com