
| A. | HNO3 | B. | H3 PO4 | C. | H2CO3 | D. | H2 SO4 |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 氢氧燃料电池工作时氢气在正极被氧化 | |
| D. | 以KOH溶液为电解质溶液的氢氧燃料电池,正极反应为O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
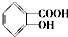 .
.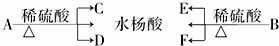
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | 水分解成氢气和氧气吸收热量 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集H2气体 | |
| C. | 图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 图④中的装置可形成持续稳定的电流.将锌片浸入CuSO4溶液中发生的化学反应与图④中的原电池装置反应不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com