
| A. | 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同. |
分析 A.电解质溶液中呈电中性,根据电荷守恒判断;
B.假设NaHCO3为1mol、Ba(OH)2为3mol,二者发生反应NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,溶液中的溶质是NaOH为1mol、Ba(OH)2为2mol;
C.溶液中存在平衡:CH3COOH?H++CH3COO-,加入醋酸钠抑制醋酸的电离;
D.CH3COOH溶液中氢氧根离子源于水的电离,NaOH溶液中氢离子源于水的电离,根据醋酸中氢离子浓度与氢氧化钠溶液中氢离子浓度判断.
解答 解:A.电解质溶液中呈电中性,由电荷守恒:c(K+)+c(H+)═c(CH3COO-)+c(OH-),故A正确;
B.假设NaHCO3为1mol、Ba(OH)2为3mol,二者发生反应NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,溶液中的溶质是NaOH为1mol、Ba(OH)2为2mol,二者完全电离,则混合溶液中离子浓度大小顺序是c(OH-)>c(Ba2+)>c(Na+)>c(H+),故B正确;
C.溶液中存在平衡:CH3COOH?H++CH3COO-,加入醋酸钠,c(CH3COO-)增大,平衡逆向移动,醋酸电离程度减小,溶液的pH升高,故C错误;
D.pH=3的CH3COOH溶液中氢氧根离子浓度为10-11mol/L,CH3COOH溶液中氢氧根离子源于水的电离,pH=11的NaOH溶液中氢离子浓度为10-11mol/L,而NaOH溶液中氢离子源于水的电离,则量两溶液中水的电离程度相同,故D正确.
故选:C.
点评 本题考查离子浓度大小比较、弱电解质的电离等知识点,C选项为易错点,注意醋酸根浓度增大为主要影响因素.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 在8.12天津大爆炸中消防员喷洒双氧水以防止氰化钠污染环境:CN-+H2O2+H2O═HCO3-+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇制乙醛、乙酸制乙酸乙酯均为取代反应 | |
| B. | 乙烯制聚乙烯、苯制硝基苯均发生加聚反应 | |
| C. | 蛋白质盐析、糖类水解均为化学变化 | |
| D. | 石油分馏、煤干馏均可得到烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
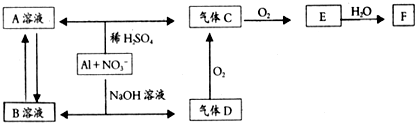

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
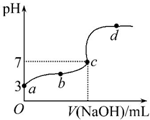 已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知在25℃条件下向10.00mL 0.1mol•L-1HCOOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A. | a点表示的溶液中c(HCOO-)约为10-3mol•L-1 | |
| B. | 用25 mL的酸式滴定管量取HCOOH溶液 | |
| C. | c点NaOH溶液的体积小于10 mL | |
| D. | 在a、c间任一点,溶液中一定都有c(HCOO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 常温下,V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 | |
| C. | 在0.1mol•L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大 | |
| D. | 原子晶体与分子晶体在溶于水和熔化时化学键均断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbCO3 | B. | SnCO3•Sn(OH)2 | C. | 2PbCO3•Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com