
 KH(IO3)2+KCl+Cl2↑,回答下列问题:
KH(IO3)2+KCl+Cl2↑,回答下列问题: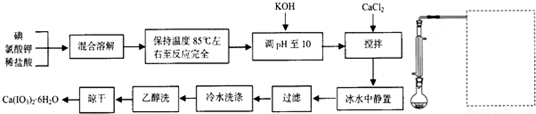
 KH(IO3)2+KCl+Cl2↑,反应过程中生成有毒气体氯气不能排放到空气中,需要用氢氧化钠溶液吸收,装置图为
KH(IO3)2+KCl+Cl2↑,反应过程中生成有毒气体氯气不能排放到空气中,需要用氢氧化钠溶液吸收,装置图为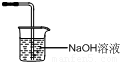 ,故答案为:
,故答案为: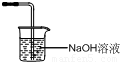 ;
; KH(IO3)2+KCl+Cl2↑,依据反应可知碘单质反应完全后生成无色物质,所以反应后溶液变化为无色证明反应完全,
KH(IO3)2+KCl+Cl2↑,依据反应可知碘单质反应完全后生成无色物质,所以反应后溶液变化为无色证明反应完全,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 KH(IO3)2+KCl+Cl2↑,回答下列问题:
KH(IO3)2+KCl+Cl2↑,回答下列问题: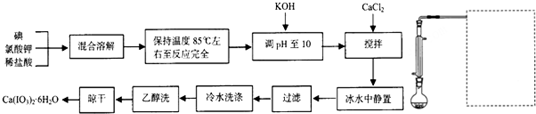
查看答案和解析>>
科目:高中化学 来源: 题型:
碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。制备碘酸钙的实验流程如下。中间产物碘酸氢钾的合成原理为:I2+2KClO3+HCl![]() KH(IO3)2+KCl+Cl2↑,回答下列问题:
KH(IO3)2+KCl+Cl2↑,回答下列问题:


(1)制备碘酸氢钾的实验装置(支撑仪器加热装置略去)如图,请在方框中补充必要的装置图并注明试剂
(2)若为上图增加加热装置,所需仪器除铁架台(带铁圈)、石棉网外还有
(3)实验中判断碘反应完全的实验现象是 (4)“调pH至10”的目的是 (5)加入CaCl2时反应的化学议程式为
(6)从水溶液中分离出碘酸钙时,可能得到无水盐、一水合物等,本实验得到的产品是Ca(IO3)2?6H2O,上述流程中与此结果密切相关的步骤是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com