
【题目】阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(![]() ),下列说法正确的是
),下列说法正确的是
A.与环戊醇互为同系物
B.分子中所有碳原子共平面
C.能使酸性高锰酸钾溶液和溴水褪色,且原理相同
D.可用碳酸钠溶液鉴别乙酸和M
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )

A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+![]() Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-0.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗称“海波”,应用非常广泛。工业上可以用亚硫酸钠法(亚硫酸钠和硫粉通过化合反应)制得,装置如图(a)所示。
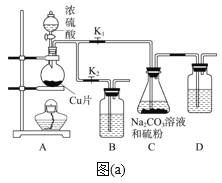
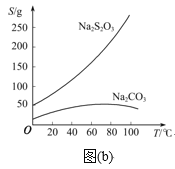
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是_____。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。装置B、D的作用是________。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是_____。
步骤4:过滤C中的混合液,将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由:____。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL。部分反应的离子方程式为:a.Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;b.I2+2S2O32-=2I-+S4O62-。则该废水中Ba2+的物质的量浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目的的是
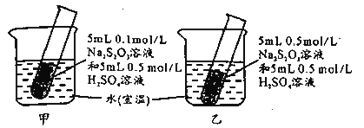
A.向甲烧杯中加入适量CaOB.向甲中试管内滴加适量浓硫酸
C.向乙烧杯中加入适量冰块D.增大甲装置所在环境的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L1 KOH溶液滴定10 mL 0.1 mol·L1 HA(Ka=1.0×105)溶液的滴定曲线如图所示。下列说法错误的是
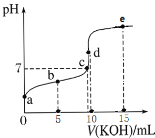
A.a点溶液的pH约为3
B.水的电离程度:d点>c点
C.b点溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e点溶液中:c(K+)=2c(A-)+2c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含![]() 、
、![]() 及少量
及少量![]() )可用于制备
)可用于制备![]() 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:

(1)“酸溶”前需粉碎烧渣,其目的是_________、________。
(2)“滤渣”的主要成分是_________(填化学式)。
(3)“还原”时,![]() 被氧化为
被氧化为![]() 的离子方程式是_________。
的离子方程式是_________。
(4)“焙烧”时,烧渣、无烟煤、![]() 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):

添加![]() 的目的是:①脱除
的目的是:①脱除![]() 等;②_________。
等;②_________。
(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以用![]() 、天门冬氨酸为原料制备。
、天门冬氨酸为原料制备。
(1)![]() 基态核外电子排布式为_______。
基态核外电子排布式为_______。
(2)![]() 的空间构型为________(用文字描述);与
的空间构型为________(用文字描述);与![]() 互为等电子体的一种阳离子的化学式为________。
互为等电子体的一种阳离子的化学式为________。
(3)天门冬氨酸( )分子中氮原子的轨道杂化类型为________;天门冬氨酸_______(填“难溶”或“易溶”)于
)分子中氮原子的轨道杂化类型为________;天门冬氨酸_______(填“难溶”或“易溶”)于![]() 盐酸。
盐酸。
(4)ZnO的晶胞结构如图所示,![]() 的配位数为________。
的配位数为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
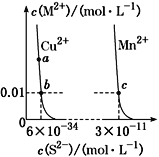
A. 在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=1∶2×10-23
B. 向CuSO4溶液中加入MnS发生反应:
Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)
CuS(s)+Mn2+(aq)
C. a点对应的Ksp等于b点对应的Ksp
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com