
【题目】欲使1L1.0mol·L-1 NaOH溶液的浓度增大一倍,可采取的合理措施是( )
A.加入40g固体NaOH,搅拌、溶解
B.将溶液取出500mL
C.加入1L3.0mol·L-1的NaOH溶液混合均匀
D.加入5mol·L-1NaOH溶液1L,再加水稀释至3L
【答案】D
【解析】
1L1.0mol·L-1 NaOH溶液中含有1molNaOH,结合c=![]() 分析判断。
分析判断。
A.40gNaOH的物质的量为![]() =1mol,搅拌、溶解,溶液中含有的氢氧化钠为2mol,由于溶解固体后,溶液的体积会发生变化,溶液的体积不是1L,浓度不是2mol/L,故A错误;
=1mol,搅拌、溶解,溶液中含有的氢氧化钠为2mol,由于溶解固体后,溶液的体积会发生变化,溶液的体积不是1L,浓度不是2mol/L,故A错误;
B.溶液具有均一性,将溶液取出500mL,浓度仍为1mol/L,故B错误;
C.加入1L 3.0mol/L的NaOH溶液混合均匀,混合液的体积不是2L,所得溶液的浓度也不是 2mol/L,故C错误;
D.加入5mol/L的NaOH溶液1L,再稀释至3L,此时溶液中氢氧化钠的浓度为:c(NaOH)=![]() =2mol/L,浓度变为原先的2倍,故D正确;
=2mol/L,浓度变为原先的2倍,故D正确;
故选D。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量
请回答下列问题:
(1)该实验的目的是_________________
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是________________
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
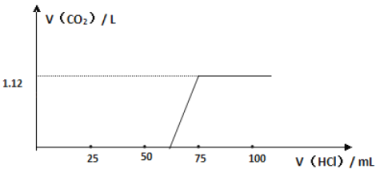
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,以下是用烯烃A和羧酸D合成它的一种路线:
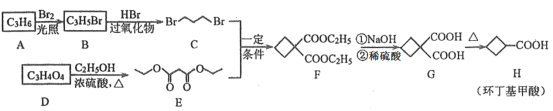
回答下列问题:
(1)A的结构简式为__________。
(2)B→C的反应类型为__________。该反应还能生成一种与C互为同分异构体的副产物,该副产物的结构简式为____________。
(3) D→E的化学方程式为_____________。
(4) M是H的同分异构体,写出同时满足下列条件的M的结构简式_____________。(不考虑立体异构)
①1molM与足量银氨溶液反应生成4molAg;②核磁共振氢谱为两组峰。
(5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2-二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为_______,乙的结构简式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,日本食品巨头明治公司生产的“明治STEP”奶粉中检测出含量超标的放射性元素铯(Cs)。铯较为稳定的核素有![]() 、
、![]() 、
、![]() 、
、![]() 。下列判断不正确的是( )
。下列判断不正确的是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() 互为同位素
互为同位素
B. ![]() 、
、![]() 、
、![]() 、
、![]() 的核外电子排布相同
的核外电子排布相同
C. ![]() 、
、![]() 、
、![]() 、
、![]() 的性质和用途相同
的性质和用途相同
D. ![]() 、
、![]() 、
、![]() 、
、![]() 的质量数和中子数均不同
的质量数和中子数均不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用来解释下列事实的离子方程式正确的是
A.钢铁发生吸氧腐蚀的正极反应:O2+4e—+2H2O=4OH—
B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe(OH)3+3H2O
C.用铜为电极电解饱和食盐水:2Cl—+2H2O![]() Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
D.碳酸氢钠溶液中加入过量石灰水:HCO3—+OH—=CO32—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液
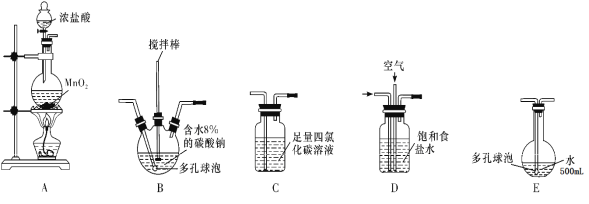
回答下列问题:
(1)各装置的连接顺序为____→_____→_____→____→E;
(2)装置 A 中反应的离子方程式是__________________;
(3)装置 E中反应的化学方程式是_____________________;
(4)装置 B 中多孔球泡和搅拌棒的作用是____,反应过程中,装置B需放在冷水中,其目的是____。
(5)装置C的主要作用是_____________________;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)______________。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
(8)配平下列离子方程式:______Fe(OH)3+ ClO![]() + OH
+ OH![]() — FeO42-+ Cl-+ H2O。
— FeO42-+ Cl-+ H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的近似值为6.02×1023.按要求完成下列填空:
(1)1molCl2中约含有______个氯气分子,约含有______个氯原子,含有6.02×1023个氢原子的H2SO4的物质的量是______;
(2)标准状况下11.2LN2O4和______molNO所含有的原子数相等。
(3)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42-的物质的量是______。
(4)2L1mol/LMgCl2中镁离子的物质的量为______,Cl-的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是
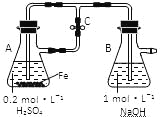
A. 用上图装置可以制备沉淀Fe(OH)2
B. 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C. FeCl3溶液中滴加KSCN溶液会生成红色沉淀
D. 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com