
下列物质的分子中既有σ键,又有π键的是
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
①②③ B.③④⑤⑥ C.①③⑥ D.③⑤⑥
科目:高中化学 来源: 题型:
下列溶液中的Cl- 数目与25mL 0.1 mol·L-1的AlCl3溶液中Cl-数目相等的是( )
A.25mL 0.1mol·L-1的BaCl2溶液
B.50mL 0.3mol·L-1的NaCl溶液
C.50 mL0.3mol·L-1的FeCl3溶液
D.75 mL 0.1mol·L-1的KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于 0.2 mol/L 硝酸钾溶液的叙述中,正确的是 ( )
A.1 L 该溶液中含硝酸钾 202 g
B.100 mL 该溶液中含硝酸钾 0.02 mol
C.从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L
D.1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿佛加德罗常数,下列说法正确的是
A.60克SiO2含有2NA个Si-O共价键
B.1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA
C.8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA
D.NA个Fe(OH)3胶体粒子的质量为107g
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol-1
② H2O(l) H2O(g) △H= + 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g) |
| 方法二 | CO2(g) +3H2(g) |
工业上可用如下方法合成甲醇:
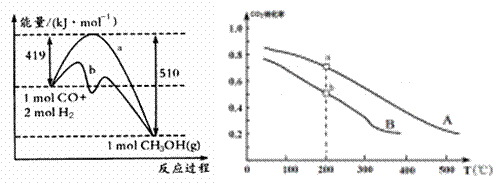
方法一 方法二
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的
倍(保留两位小数).
甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.σ键比π键的电子云重叠程度大,形成的共价键强
B.C=C双键的键能是C—C单键键能的2倍
C.s-s σ键与s-p σ键的电子云形状对称性相同
D.N2分子中有一个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | ||||||||||||||||||
| ② | ③ | |||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | |||||||||||||||
| ⑧ | ⑨ | ⑩ |
请回答下列问题:
(1)表中属于d区元素的是 (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见
溶剂的化学式为 ,其立体构型为________________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与
元素①所形成化合物的水溶液显 性(填“酸”或“碱”)。
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为 。
(6)元素⑩的基态原子核外电子排布式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在生产、生活和科技等方面的叙述不正确的是( )
A.生铁、普通钢和不锈钢中的碳含量依次增加
B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂
C.节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩
D.明矾在自然水中生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com