
| HCN | HF | CH3COOH | HNO2 | |
| Ka | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | CHSCOOH | C. | HF | D. | HNOp |
科目:高中化学 来源: 题型:选择题
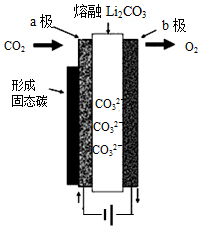 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )| A. | 化学能转变为电能 | |
| B. | 阴极的电极反应为:CO2+4e-=C↓+2O2- | |
| C. | 阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑ | |
| D. | 阴极上每通过4mole-,阴极区有1molCO2参与反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 液氯和氯水中滴入硝酸银溶液均会产生白色沉淀 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,80 g SO3所占的体积约为22.4 L | |
| B. | 常温常压下,1.6 gO2和O3混合气体中质子总数为0.8NA | |
| C. | 0.1 mol甲基(-CH3)所含电子数为NA | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
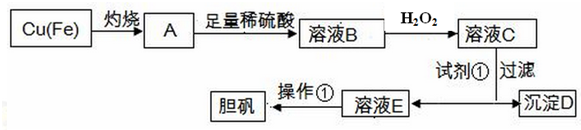
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
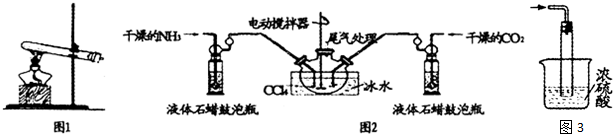
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
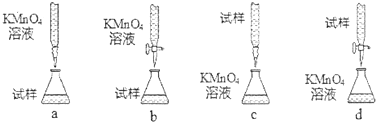
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com