
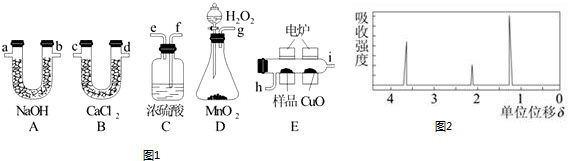
分析 (1)(2)(3)实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式,再结合有机物相对分子质量确定分子式.D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B吸收水,测定生成水的质量,通过A吸收二氧化碳,测定生成二氧化碳的质量;
(4)计算水、二氧化碳的物质的量,根据质量守恒定律计算O元素质量,再根据原子守恒确定有机物的最简式,若最简式中H原子已经饱和碳的四价结构,则最简式即为分子式,否则还要知道该物质的相对分子质量,才能确定分子式;
(5)该物质的核磁共振氢谱有3个吸收峰,故有机物分子中有3种H原子,结合分子式确定其结构简式,书写可能的结构简式.
解答 解:实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式,再结合有机物相对分子质量确定分子式.D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B吸收水,测定生成水的质量,通过A吸收二氧化碳,测定生成二氧化碳的质量.
(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果,
故答案为:吸收水分干燥氧气;
(2)MnO2为分解制备氧气的催化剂,
故答案为:作催化剂加快产生O2的速率;
(3)一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知,CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
故答案为:把有机物不完全燃烧产生的CO转化为CO2;
(4)水的物质的量=$\frac{1.08g}{18g/mol}$=0.06mol、二氧化碳的物质的量=$\frac{1.76g}{44g/mol}$=0.04mol,则m(C)+m(H)=0.04mol×12g+0.06mol×2×1g/mol=0.6g<0.92g,故有机物含有O元素,m(O)=0.92g-0.6g=0.32g,则n(O)=$\frac{0.32g}{16g/mol}$=0.02mol,n(C):n(H):n(O)=0.04:0.12:0.02=2:6:1,该有机物的实验式是C2H6O,由于2个C原子最多结合6个H原子,故分子式为C2H6O,
故答案为:C2H6O;
(5)该有机物分子式为C2H6O,该物质的核磁共振氢谱有3个吸收峰,故有机物分子中有3种H原子,所以其结构简式为:CH3CH2OH,该有机物的同分异构体结构简式为CH3OCH3,
故答案为:CH3CH2OH;CH3OCH3.
点评 本题考查有机物的分子式的实验测定,题目难度中等,关键在于清楚实验的原理,掌握燃烧法利用元素守恒确定实验式的方法.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
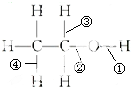
| A. | 乙醇与金属钠反应断裂②键 | B. | 乙醇与溴化氢反应断裂①键 | ||
| C. | 乙醇催化氧化变乙醛断裂①③键 | D. | 乙醇分子内脱水断裂①③键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 因为氯元素非金属性比硫元素强,所以次氯酸的酸性比硫酸强 | |
| C. | 每一周期都是从金属元素开始,非金属元素结束 | |
| D. | 现常见的元素周期表有七个横行,即七个周期,有18个纵行,分为16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 元素②与元素③处于同一周期 | |
| B. | 元素④的原子序数小于元素⑦的 | |
| C. | 元素⑧的还原性比元素⑥的强 | |
| D. | 元素⑤的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com