
已知弱酸的电离平衡常数如下表,下列选项正确的是( )
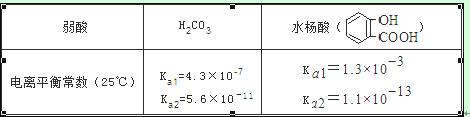
A.常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH
溶液pH
B.常温下,等浓度、等体积的Na2 CO3 溶液和 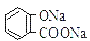 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者
C.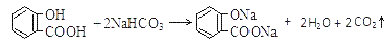
D.水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的CO、NO2等有毒气体有关。对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是 ( )。
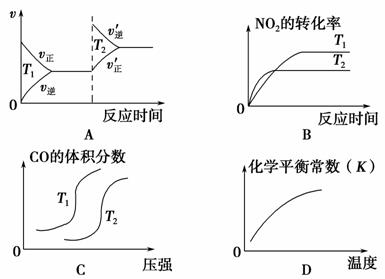
查看答案和解析>>
科目:高中化学 来源: 题型:
实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是 ( )。
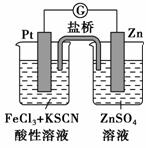
A.该原电池的正极反应是Zn-2e-===Zn2+
B.左烧杯中溶液的血红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对如图所示实验装置的判断中错误的是 ( )。

A.若 X 为碳棒,开关 K 置于 A 处可减缓铁的腐蚀
B.若 X 为锌棒,开关 K 置于 A 或 B 处均可减缓铁的腐蚀
C.若 X 为锌棒,开关 K 置于 B 处时,为牺牲阳极的阴极保护法
D.若 X 为碳棒,开关 K 置于 B处时,铁电极上发生的反应为2H+ +
2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.一定条件下,2molSO2和1molO2混合在密闭容器中
充分反应后容器中的分子数大于2NA
B.256g S8分子中含S-S键为7NA个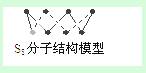
C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。 A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为
。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
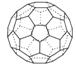 (3)A的一种单质相对分子质量为720,分子构型为一个32面体,
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,
|
种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示
 的堆积方式。则这种堆积模型的配位数为 ,
的堆积方式。则这种堆积模型的配位数为 ,
如果X的原子半径为a cm,阿伏加德常数的值为
NA,则计算此单质的密度表达式为 g/cm3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子
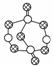
B.17.4 g某硫化磷(如图)中含P—S键数目为0.6NA
C.1 mol含8个碳原子的某烃分子,最多形成7 mol碳碳单键
D.标准状况下,22.4 L SO2与O2混合气体,含有2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)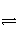
 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)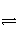
 2H2O(g),
2H2O(g),
K=2×1081 mol-1·L;
③2CO2(g)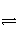
 2CO(g)+O2(g),K=4×10-92 mol·L-1
2CO(g)+O2(g),K=4×10-92 mol·L-1
则常温下,NO、H2O、CO2这三种化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,NaBH4+2H2O===NaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com