
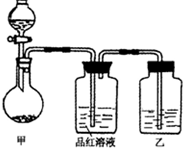
 张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.| 实验操作 | 预期现象和结论 |
| ______ | ______ |

 CuSO4+SO2↑+2H2O(或C+2H2SO4(浓)
CuSO4+SO2↑+2H2O(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O);
CO2↑+2SO2↑+2H2O); CuSO4+SO2↑+2H2O(或C+2H2SO4(浓)
CuSO4+SO2↑+2H2O(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O);
CO2↑+2SO2↑+2H2O);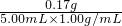 ×100%=3.4%,故答案为:3.4%.
×100%=3.4%,故答案为:3.4%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 (2009?三明一模)张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
(2009?三明一模)张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
| ||
| ||
| ||
| ||
| 实验操作 | 预期现象和结论 |
往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液 往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液 |
若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质 若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质 |

查看答案和解析>>
科目:高中化学 来源:三明一模 题型:填空题
| 实验操作 | 预期现象和结论 |
| ______ | ______ |
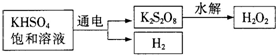
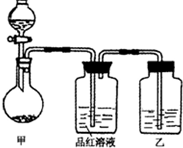
查看答案和解析>>
科目:高中化学 来源:辽宁省模拟题 题型:实验题
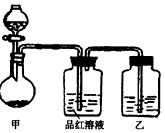

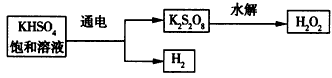
查看答案和解析>>
科目:高中化学 来源:2009年福建省三明市高考化学一模试卷(解析版) 题型:填空题
| 实验操作 | 预期现象和结论 |
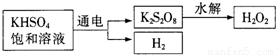
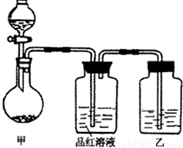
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com