
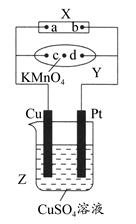
| A.滤纸上c点附近会变红色 |
| B.Cu电极质量减小,Pt电极质量增大 |
| C.Z中溶液的pH先减小,后增大 |
| D.溶液中的SO42—向Cu电极定向移动 |
科目:高中化学 来源:不详 题型:单选题
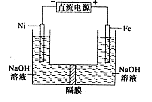
| A.铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.10 mol·L-1AgNO3溶液 |
| B.0.10 mol·L-1ZnSO4溶液 |
| C.0.20 mol·L-1CuCl2溶液 |
| D.0.20 mol·L-1Pb(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

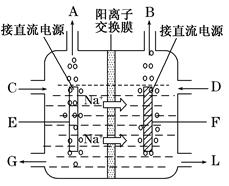
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
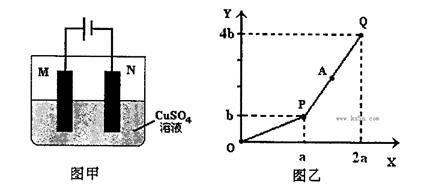
| A.电解过程中N电极表面先有红色物质生成,后有气泡产生 |
| B.A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态 |
| C.Q点时M、N两电极上产生的气体在相同条件下体积相同 |
| D.若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
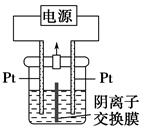
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含IO3— |
C.电解槽内发生反应的总化学方程式:KI+3H2O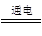 KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | S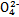 | HC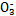 |
| 含量/(mg·L-1) | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
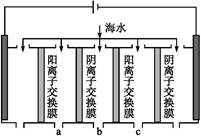
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com