
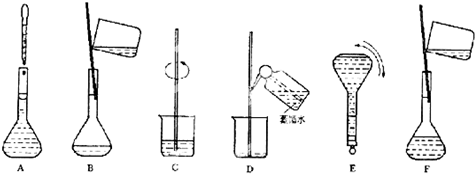
| 实验目的 | 试剂及方法 |
| 证明地瓜中有淀粉 | B |
| 除去CO2中混有的少量CO | D |
| 检验FeCl2溶液是否变质 | C |
| 除去Na2CO3固体中NaHCO3 | A |
分析 淀粉遇碘单质变蓝;
CO与CuO反应生成二氧化碳;
FeCl2溶液变质时混有铁离子,铁离子遇KSCN溶液为血红色;
NaHCO3加热分解生成碳酸钠,以此来解答.
解答 解:淀粉遇碘单质变蓝,则滴加碘水可证明,则选择B;
CO与CuO反应生成二氧化碳,则通过灼热的CuO可除杂,应选择D;
FeCl2溶液变质时混有铁离子,铁离子遇KSCN溶液为血红色,则检验是否变质可加入KSCN溶液,即选择C;
NaHCO3加热分解生成碳酸钠,则加热可除杂,即选择A,
故答案为:B;D;C;A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol•L-1 | B. | 0.50mol•L-1 | C. | 0.20 mol•L-1 | D. | 0.25 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用工业石蜡给瓜子美容 | B. | 用工业酒精(含甲醇)配兑饮用酒 | ||
| C. | 食用加碘盐预防碘缺乏病 | D. | 食用亚硝酸盐超标的腊肉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度(℃) | N2(mol) | H2(mol) | 催化剂 |
| A | 500 | 1 | 3 | 有 |
| B | 500 | 0.5 | 1.5 | 有 |
| C | 450 | 1 | 3 | 无 |
| D | 450 | 0.5 | 1.5 | 无 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由途径①和②分别制取1mol FeCl2,理论各消耗1mol Fe,各转移2mol e- | |
| B. | 由途径③和④分别制取1mol Na2SO4,理论各消耗1mol Cl2,各转移2mol e- | |
| C. | 由途径⑤和⑥分别制取1mol H2SO4,理论各消耗1mol S,各转移6 mol e- | |
| D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -48.5 KJ•mol-1 | B. | +48.5 KJ•mol-1 | C. | -45.5KJ•mol-1 | D. | +45.5 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com