
| A. | 维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高 | |
| B. | 2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求 | |
| C. | 稀的双氧水可用于清洗伤口,以达到杀菌、消毒的目的 | |
| D. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
分析 A.维生素易被氧化;
B.绿色化学即对环境友好型化学,要求原料物质中所有的原子完全被利用且全部转入期望的产品中,原子的利用率100%;
C.双氧水有强氧化性;
D.Si3N4、Al2O3熔点高.
解答 解:A.维生素易被氧化,加工后食品维生素含量降低,故A错误;
B.反应物能全部转化为生成物,符合绿色化学,故B正确;
C.双氧水有强氧化性,可以消毒杀菌,故C正确;
D.Si3N4、Al2O3熔点高,可用于制作高温结构陶瓷制品,故D正确.
故选A.
点评 本题考查较为综合,为高考常见题型,侧重于元素化合物知识与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径依次增大 | B. | 离子半径依次增大 | ||
| C. | 单质的密度依次逐渐增大 | D. | 氢氧化物的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的PH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 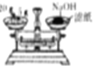 称量NaOH固体 | B. | 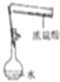 配制一定物质的量浓度稀硫酸 | ||
| C. | 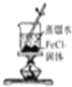 制取少量的Fe(OH)3胶体 | D. | 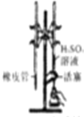 用H2SO4标准溶液滴定NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| B. | 棉、丝、羽毛、塑料及合成橡胶完全燃烧都只生成CO2和H2O | |
| C. | 纤维素、合成纤维、光导纤维都是有机高分子化合物 | |
| D. | 液化石油气可由石油分馏获得,汽油可由石油分馏或石油裂化获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol由元素A、B组成的化合物一定含有18mole- | |
| B. | 化合物AE与DE3有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素D的最高价氧化物对应的水化物可以溶于过量的氨水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 结论 |
| A | 取某Na2SO3溶液,加入足量的稀盐酸,产生气泡,再滴加BaCl2溶液,产生白色沉淀. | Na2SO3已部分被氧化 |
| B | 向2mL0.1mol/LNaOH溶液中滴加0.1mol/LMgCl2溶液3滴,出现白色沉淀后,再滴加3滴0.1mol/L FeCl3溶液,出现红褐色沉淀. | 溶解度:Mg(OH)2>Fe(OH)3 |
| C | 向氯水中通入足量SO2,氯水褪色. | SO2具有漂白性 |
| D | 相同温度下,测等浓度的Na2CO3和Na2SO3水溶液的pH:pH (Na2CO3)>pH(Na2SO3). | 非金属性强弱:C>S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
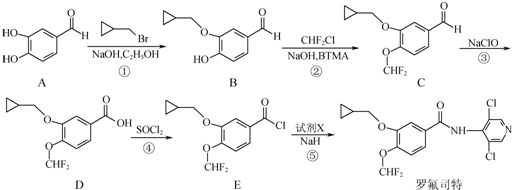
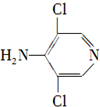 .
.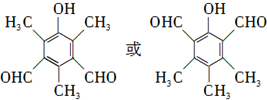 等.
等.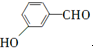 、CH3CH2OH为原料制备
、CH3CH2OH为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
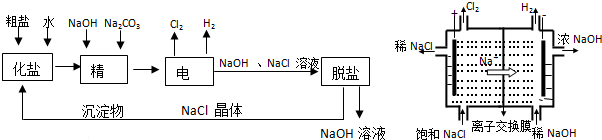
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com