
| A、将4mol Cl2通入到含有4mol FeBr2的溶液中:2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+ |
| B、已知亚硫酸(H2SO3)的第二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:AlO2-+SO2+2 H2O=Al(OH)3↓+HSO3- |
| C、稀氨水溶液吸收了少量二氧化碳气体:NH3?H2O+CO2=NH4++HCO3- |
| D、在明矾溶液中加入氢氧化钡溶液至沉淀质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |


科目:高中化学 来源: 题型:
| A、(1)(3) |
| B、(1)(2) |
| C、只有(3) |
| D、只有(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯水在25℃和100℃时的pH |
| B、相同温度10mL0.1mol?L-1的盐酸溶液与10mL 0.1mol?L-1的醋酸溶液水电离出的c(H+) |
| C、0.1mol/LNaOH溶液分别中和pH、体积均相同的醋酸和盐酸,消耗NaOH溶液的体积 |
| D、相同温度下0.1mol/LCH3COOH溶液和0.3mol/LCH3COOH溶液中的电离平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前者基本没有改变、后者变棕黄色 |
| B、前者变棕黄色、后者也变棕黄色 |
| C、前者变棕黄色、后者基本没有改变 |
| D、前者、后者都基本没有改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
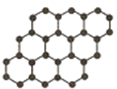 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、12g石墨烯中含有3NA个C-C键 |
| C、石墨烯是一种有机物 |
| D、石墨烯中的碳原子间以共价键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何气体所含分子数都相同,体积也都约为22.4 L |
| B、1molKClO3和1molSO2中,所含氧原子的个数比为3:2 |
| C、物质的量就是物质的摩尔质量 |
| D、在非标准状况下,1 mol任何物质的体积都不是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com