
| A.金属钠投入蒸馏水2Na+2H2O=2Na++20H-+H2↑ |
| B.向亚硫酸钠溶液中加入足量硝酸S032-+2H+=S02↑+H2O |
| C.用浓盐酸与Mn02反应制取少量氯气Mn02+4H++2Cl-=Mn2++2H2O+Cl2↑ |
| D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H202=Fe3++2H2O |
| ||


科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3+2HCl=2NaCl+CO2↑+H2O |
| B.K2CO3+2HNO3=2KNO3+CO2↑+H2O |
| C.K2CO3+H2SO4=K2SO4+CO2↑+H2O |
| D.CaCO3+2HCl=CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀醋酸与氢氧化钾溶液反应H++OH-=H2O |
| B.铝与稀盐酸反应Al+2H+=Al3++H2↑ |
| C.三氯化铁溶液与氢氧化钠溶液反应Fe3++3OH-=Fe(OH)3↓ |
| D.过量二氧化碳与石灰水反应CO2+2OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/LCH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ |
| B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)(红棕色)?N2O4(g)(无色)△H<0 |
| C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO═3Fe2++2NO↑+4H2O |
| D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 离子方程式 | 评价 |
| A | 将1mol Cl2通入到含1mol FeI2的溶液中: 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将 Fe2+、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO3-+OH-=MgCO3↓+H2O | 正确;酸式盐与碱反应 生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性: H2SO3强于HClO |
| D | 1mol/L的NaAl(OH)4溶液和2.5mol/L的HCl溶 液等体积互相均匀混合:2[Al(OH)4]-+5H+=Al3++Al(OH)3↓+5H2O | 正确:[Al(OH)4]-与Al(OH)3消耗的H+的物 质的量之比为2:3 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
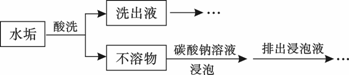
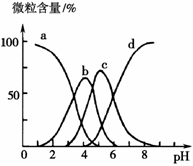
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32- |
| C.无色溶液:Ba 2+、Na+、MnO4-、NO3- |
| D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com