
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大。五种元素中,仅R为金属元素,其原子序数为27。X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个。
根据判断出的元素回答下列问题:

(1)基态R原子核外电子排布式为 。
(2)1mol配合物[R(XY)6]4-中含有σ键的数目为 。
(3)XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 ,其沸点高于甲醛的主要原因是 。
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为 (用文字描述)。
(5)R与某元素A构成的晶体的晶胞结构如下图所示,则R的配位数是 ,A的配位数是 。
(6)在答卷的图中画出与顶点m配位的所有A原子。
【答案】(1)1s22s22p63s23p63d74s2或[Ar]3d74s2⑵12mol或12×6.02×1023
(3)sp2,因为COCl2的相对分子质量比甲醛大,故范德华力比甲醛大,导致其沸点比甲醛(4)三角锥形(5)4,2(6)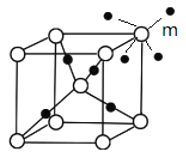
【解析】试题分析:原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大,五种元素中,仅R为金属元素,其原子序数为27,则R为Co元素;X价电子排布式为nsnnpn,n=2,则X的电子排布式为2s22p2,X为C元素;元素Z基态原子s电子总数与p电子总数相等,则Z的电子排布式只能为1s22s22p2,为O元素;结合Y的原子序数可知Y为N元素;W与其它四种元素能层数不同,且未成对电子数目为1个,Y只能位于第三周期,为Cl元素。
(1)R的原子序数为27,其基态原子核外电子总数为27,其核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2;
(2)[R(XY)6]4-为[Co(CN)6]4-,[Co(CN)6]4-中CN-与Co之间有6个配位键,在每个CN-内部有一个σ键,所以1mol该配合物中含有σ键的数目为12NA(或12×6.02×1023);
(3)XZW2为COCl2,与甲醛结构相似,则其分子中含有1个碳氧双键和2个C-Cl单键,其中心原子C采用sp2杂化;由于COCl2的相对分子质量比甲醛大,则范德华力比甲醛大,导致其沸点高于甲醛;
(4)NCl3的分子中N原子形成3个N-Cl键,含有1对孤电子对,故其立体构型为三角锥形;
(5)晶胞中R原子数目为1+8×1/8=2,A原子数目为4,由图可知R的配位数是4,则A的配位数是4×2/4=2;
(6)白色球与周围的4个黑色球形成正四面体结构.利用平移法在图中画出与顶点m配位的所有A原子为 。
。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.可以从煤干馏得到的煤焦油中分离出苯
B.分子式符合C6H6的有机物一定是苯
C.苯的邻二取代物只有一种,说明苯环内不存在单双键交替的结构
D.苯不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体正常的血红蛋白中应含Fe2+,若误食亚硝酸盐,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述正确的是( )
A.亚硝酸盐是还原剂B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属单质A经下图所示的过程转化为含氧酸D,
![]()
已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①氯水和B皆可作漂白剂。若同时使用于漂白一种物质时,其漂白效果是________(填“增强”“减弱”“不变” ),用化学方程式解释上述原因 ;
②D的浓溶液与铜发生反应的化学方程式: 。
(2)若A在常温下为气体,C是红棕色气体。
①A转化为B的化学方程式是:______________________________________,
② D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茅台酒中存在少量有凤梨香味的物质X,其结构如右图所示。下列说法正确的是( )

A.X难溶于乙醇
B.酒中的少量丁酸能抑制X的水解
C.分子式为 C4H8O2且官能团与X相同的物质有5种
D.X完全燃烧后生成CO2和H2O的物质的量比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( )
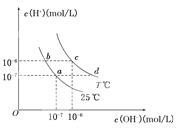
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl―、SO42―
B.b点对应的溶液中大量存在:NH4+、Ba2+、OH―、I―
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl―、HCO3―
D.d点对应的溶液中大量存在:Na+、K+、SO32―、Cl―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式____________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如图所示。

①T℃时该化学反应的平衡常数K=_________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8 mol,平衡将_______移动。(填“向左”、“向右”或“不”)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________。(填“a”或“b”)
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____________。
(二)SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是_____________。
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。
①写出物质A的化学式_____________,阳极的电极反应式是____________Cl。
②该电解反应的化学方程式为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醇(![]() )是一种重要的化工原料,
)是一种重要的化工原料,
Ⅰ.在一定条件下以CO和H2为原料可以合成乙二醇,反应方程式如下:
2CO(g)+3H2(g) ![]()
![]() (g) ΔH= a kJ/mol
(g) ΔH= a kJ/mol
(1)该反应能够自发进行,可以推出a 0;(填“>”“<”或“=”)。
(2)在一定温度下,向体积为1L的恒容密闭容器中充入2 mol CO (g)和3mol H2(g),压强为P1,达到平衡时压强变为P2,且P1:P2=15:7,则该温度下的化学平衡常数K=______
(3)只改变反应的一个条件,能使平衡体系中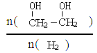 增大的措施有 (写两条)
增大的措施有 (写两条)
Ⅱ.乙二醇经连续催化氧化后可得到乙二酸(HOOC-COOH),乙二酸俗称草酸,分子式可以用H2C2O4表示,H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.0×10-2,K2=5.0×10-5
(1)H2C2O4的电离方程式为 。
(2)Na2C2O4溶液显 (填“酸性”、“中性”或“碱性”),溶液中各离子浓度从大到小的顺序为 。
(3)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,常温下,
反应NH3·H2O + HC2O4- ![]() NH4+ +C2O42-+H2O的平衡常数K= 。
NH4+ +C2O42-+H2O的平衡常数K= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com