
(16分)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)==IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq)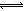 HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq)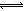 I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)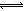 I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。
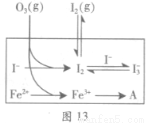
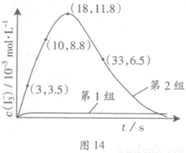
(3)为探究Fe2+对氧化I-反应的影响(反应体系如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
编号 | 反应物 | 反应前pH | 反应后pH |
第1组 | O3+ I- | 5.2 | 11.0 |
第2组 | O3+ I-+ Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为 。由Fe3+生成A的过程能显著提高I-的转化率,原因是_______。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3~18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
(1)2 I-+O3+2H+==I2+O2+H2O(2分,其他合理学科网答案也给分)
△H1+△H2+△H3(1分)
(2)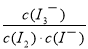 (2分)
(2分)
(3)①O3氧化I-生成I2的反应消耗H+,使H+浓度减小(2分,其他合理表达也给分)
②Fe(OH)3(1分) 由于Fe3+的水解,体系中H+浓度增加,使O3氧化I-的两个分步反应②和③的平衡向右移动,I-的转化率提高
③BC(3分,错选不给分,少选且选对给1分)
(4)v(I3-)=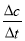 =
=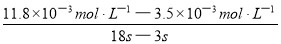 ≈5.5×10-4mol?L-1?s-1(3分,其他合理学科网答案也给分)
≈5.5×10-4mol?L-1?s-1(3分,其他合理学科网答案也给分)
【解析】(1)臭氧将碘离子氧化成碘单质的过程由3步反应组成,观察已知3个热化学方程式中的反应物和生成物,不难发现①+②+③不仅可以约去中间产物或中间反应物[如IO-(aq)、HOI(aq)],而且可得总反应的热化学方程式,即2 I-(aq)+ O3(g) +2H+(aq) 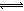 I2(aq) +O2(g)+H2O(l),根据盖斯定律可得其焓变△H=△H1+△H2+△H3;氢离子表示强酸,如硫酸等,将臭氧持续通入NaI溶液中,总反应的化学方程式可以是2NaI+O3+H2SO4
I2(aq) +O2(g)+H2O(l),根据盖斯定律可得其焓变△H=△H1+△H2+△H3;氢离子表示强酸,如硫酸等,将臭氧持续通入NaI溶液中,总反应的化学方程式可以是2NaI+O3+H2SO4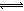 Na2SO4+I2+O2+H2O或2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O等;(2)由化学平衡常数定义式可得,I2(aq)+ I-(aq)
Na2SO4+I2+O2+H2O或2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O等;(2)由化学平衡常数定义式可得,I2(aq)+ I-(aq) 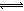 I3-(aq)的平衡常数表达式为
I3-(aq)的平衡常数表达式为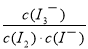 或c(I3-)/[c(I2)?c(I-)];(3)①导致反应后pH升高的原因是臭氧将碘离子氧化为I2的总反应的离子方程式为2I-+O3+2H+
或c(I3-)/[c(I2)?c(I-)];(3)①导致反应后pH升高的原因是臭氧将碘离子氧化为I2的总反应的离子方程式为2I-+O3+2H+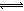 I2+O2(g)+H2O(或者第②③步反应的反应物中都有氢离子,第③步反应的生成物中有水),既消耗氢离子又生成水,导致溶液的酸性减弱、pH升高;②图13中A不可能为Fe2+,因为加入Fe2+后,发生如下反应:2Fe2++O3+2H+==2Fe3++H2O、2Fe3++2I-==2Fe2++I2,随着反应的进行,I-消耗贻尽,持续通入O3,Fe2+完全转化为Fe3+,即铁元素只能以正三价的价态存在;图13中A为Fe(OH)3,依题意可知第2组反应后pH=4.1,则c(H+)= 1.0×10-4.1 mol/L,c(OH-)= 1.0×10-9..9mol/L,由于Fe(OH)3(s)
I2+O2(g)+H2O(或者第②③步反应的反应物中都有氢离子,第③步反应的生成物中有水),既消耗氢离子又生成水,导致溶液的酸性减弱、pH升高;②图13中A不可能为Fe2+,因为加入Fe2+后,发生如下反应:2Fe2++O3+2H+==2Fe3++H2O、2Fe3++2I-==2Fe2++I2,随着反应的进行,I-消耗贻尽,持续通入O3,Fe2+完全转化为Fe3+,即铁元素只能以正三价的价态存在;图13中A为Fe(OH)3,依题意可知第2组反应后pH=4.1,则c(H+)= 1.0×10-4.1 mol/L,c(OH-)= 1.0×10-9..9mol/L,由于Fe(OH)3(s) Fe3+ (aq) +3OH-(aq),Ksp [Fe(OH)3]=c(Fe3+)×c 3 (OH-)=4.0×10-38,则c(Fe3+)=
Fe3+ (aq) +3OH-(aq),Ksp [Fe(OH)3]=c(Fe3+)×c 3 (OH-)=4.0×10-38,则c(Fe3+)=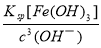 =
=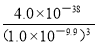 ≈4.0×10-8.3 mol/L,由于4.0×10-8.3 mol/L远远小于1.0×10-5mol/L,说明Fe3+已经完全沉淀,则A为Fe(OH)3;由于Fe3++3H2O
≈4.0×10-8.3 mol/L,由于4.0×10-8.3 mol/L远远小于1.0×10-5mol/L,说明Fe3+已经完全沉淀,则A为Fe(OH)3;由于Fe3++3H2O Fe(OH)3+3 H+, Fe3+的水解导致体系中H+浓度增加,使O3氧化I-的两个分步反应②和③的平衡向右移动,I-的转化率提高;③对比表格中第1、2组实验前后pH可得,第1组pH增大,c(H+)减小,图中第1组实验所得I3-浓度曲线先略为增大后几乎不变,第2组pH减小,c(H+)增大,图中第2组实验所得I3-浓度曲线先显著增大后逐渐减小至无,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,A项错误;若c(I-)减小,则反应③HOI(aq)+I-(aq)+H+(aq)
Fe(OH)3+3 H+, Fe3+的水解导致体系中H+浓度增加,使O3氧化I-的两个分步反应②和③的平衡向右移动,I-的转化率提高;③对比表格中第1、2组实验前后pH可得,第1组pH增大,c(H+)减小,图中第1组实验所得I3-浓度曲线先略为增大后几乎不变,第2组pH减小,c(H+)增大,图中第2组实验所得I3-浓度曲线先显著增大后逐渐减小至无,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,A项错误;若c(I-)减小,则反应③HOI(aq)+I-(aq)+H+(aq)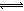 I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)
I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq) 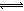 I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)
I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)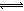 I2(g)的溶解平衡右移,既使溶液中c(I2)减小,又使 I2(aq)+I-(aq)
I2(g)的溶解平衡右移,既使溶液中c(I2)减小,又使 I2(aq)+I-(aq)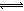 I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-直接氧化成I2或发生反应2Fe3++2I-==2Fe2++I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)
I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-直接氧化成I2或发生反应2Fe3++2I-==2Fe2++I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq) 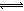 I3-(aq)的平衡右移,I3-浓度增大,D项错误;(4)读图14,3~18s内第2组实验中I3-浓度由 3.5×10-3mol/L增加到11.8×10-3mol/L,则生成I3-的平均反应速率v(I3-)=
I3-(aq)的平衡右移,I3-浓度增大,D项错误;(4)读图14,3~18s内第2组实验中I3-浓度由 3.5×10-3mol/L增加到11.8×10-3mol/L,则生成I3-的平均反应速率v(I3-)=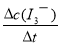 =
=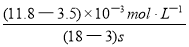 ≈5.5×10-4mol/(L?s),此问需要注意纵坐标中 “c(I3-)/ 10-3mol?L-1” 隐含的信息,计算时需要图中所得数据乘以“×10-3 mol?L-1”。
≈5.5×10-4mol/(L?s),此问需要注意纵坐标中 “c(I3-)/ 10-3mol?L-1” 隐含的信息,计算时需要图中所得数据乘以“×10-3 mol?L-1”。
【学科网考点定位】本题以大气中的部分碘源于O3对海水中I-的氧化为背景考查了考生对中学化学的重要原理掌握情况;考查考生对热化学方程式含义、盖斯定律的理解,以及利用盖斯定律进行有关反应热计算的能力。考查考生对化学反应可逆性、平衡常数表达式的书写的理解程度;考查考生考查考生正确判断、解释和说明有关化学现象和问题的能力;考查考生对浓度、催化剂等外界因素对平衡移动的影响等知识的理解;考查考生读解图表、提取信息的能力;考查考生对化学反应速率概念、计算方法以及影响速率的因素的了解和理解。


科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(天津卷解析版) 题型:填空题
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:填空题
(本题共14分)
M是一种治疗直肠癌和小细胞肺癌药物的主要成分,其结构式为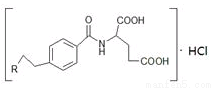 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为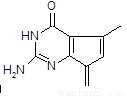 )。M的一条合成路线如下(部分反应试剂和条件略去)。
)。M的一条合成路线如下(部分反应试剂和条件略去)。
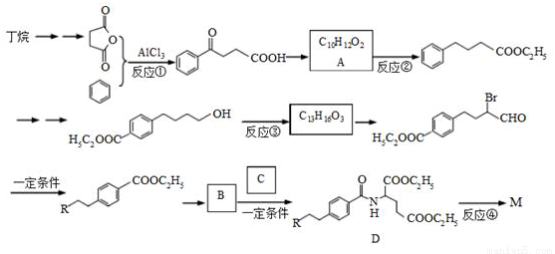
完成下列填空:
(1)写出反应类型。 反应①_________ 反应③__________
(2)写出反应试剂和反应条件。反应②_________ 反应④__________
(3)写出结构简式。 B_____________ C_____________
(4)写出一种满足下列条件的A的同分异构体的结构简式。
(1)能与FeCl3溶液发生显色反应;(2)能发生银镜反应;(3)分子中有5种不同化学环境的氢原子。
(5)丁烷氯代可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。
(合成路线常用的表示方法为:A B……
B…… 目标产物)
目标产物)
(6)已知:R-CO-NHR′与R-CO-OR′的化学性质相似。
从反应④可得出的结论是:_______________________。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:选择题
下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是
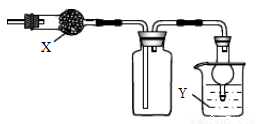
选项 | X | 收集气体 | Y |
A | 碱石灰 | 氯化氢 | 水 |
B | 碱石灰 | 氨气 | 水 |
C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:选择题
结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物用碘蒸气处理后,其导电能力大幅提高。上述高分子化合物的单体是
A.乙炔 B.乙烯 C.丙烯 D.1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源:2013年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
下列措施不合理的是
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:填空题
[化学一选修2:化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
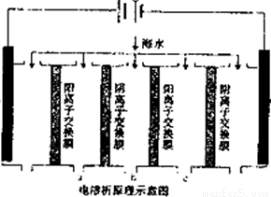
①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子氧化为溴单质,则处理l.0×10 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________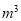 。
。
(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水, 若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
(5)工程塑料ABS合成时,用了以下三种单体: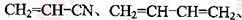 、
、
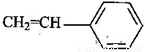 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
下列解释实际应用的原理表达式中,不正确的是
A. 用排饱和食盐水法收集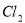 :
: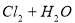

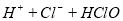
B. 热的纯碱溶液碱性增强: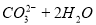

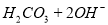
C. 向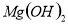 悬浊液中加入
悬浊液中加入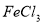 溶液:
溶液: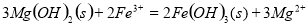
D. 配制FeCl3溶液时为防止溶液浑浊常加入少量稀盐酸Fe3++3H2O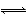 Fe(OH)3+3H+,
Fe(OH)3+3H+,
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:填空题
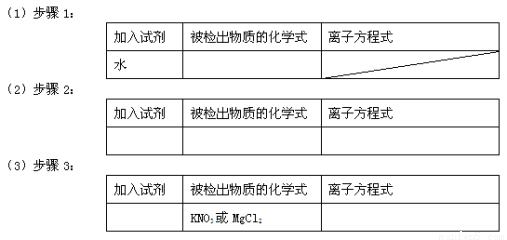
(8分)已知四种白色粉末分别是KNO3、MgCl2、Ba(OH)2、无水CuSO4中的一种。现只提供蒸馏水一种试剂,对这些物质进行鉴别(被鉴别出的物质可作为试剂来鉴别其他物质)。请按要求填写下列表格:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com