
| ||
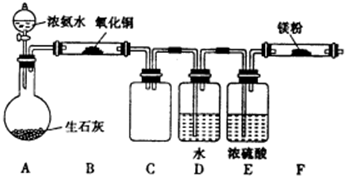
| ||
| ||
| ||
| ||


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、CO2 |
| B、生活污水 |
| C、SO2、NO2、可吸入颗粒 |
| D、废旧电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中化学能只可以转化为热能 |
| B、可逆反应达到平衡后,正、逆反应速率均为0 |
| C、N2和H2反应达到平衡后,无N2或H2剩余 |
| D、化学反应中一定有化学键的断裂和形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂可以加快反应速率 |
| B、升高温度可以加快反应速率 |
| C、使用过量乙醇能使乙酸完全转化为乙酸乙酯 |
| D、该反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
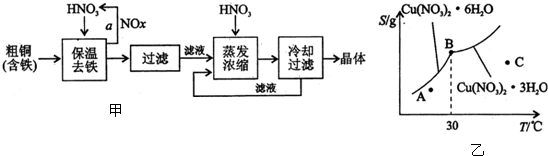
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com