
【题目】苯胺为无色液体,还原性强,易被氧化,有碱性,与酸反应生成盐,硝基苯与氢气制备苯胺(沸点为184℃)的反应原理如下:
 +3H2
+3H2![]()
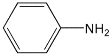 +2H2O
+2H2O
某同学设计的制备实验装置(部分夹持装置省略)如图:

下列说法正确的是( )
A.仅用上述装置图中仪器就可以完成该实验
B.用硝酸代替盐酸,反应速率更快,实验效果较好
C.点燃酒精灯前,打开K,先通一段时间的H2
D.三颈烧瓶内的反应结束后,关闭K,先在三颈烧瓶中加入浓硫酸后蒸馏
【答案】C
【解析】
A.因为苯胺为无色液体,与酸反应生成盐,锌与盐酸反应制得的氢气中有氯化氢,通入三颈烧瓶之前应该除去,所以缺少一个除杂装置,故A错误;
B.锌与硝酸反应生成硝酸锌、二氧化氮(或一氧化氮)和水,不能生成氢气,达不到实验目的,故B错误;
C.苯胺还原性强,易被氧化,所以制备苯胺前用氢气排尽装置中空气,同时氢气是可燃性气体,点燃时易发生爆炸,所以点燃酒精灯之前,先打开K,通入一段时间的氢气,排尽装置中的空气,故C正确;
D.苯胺还原性强,易被氧化,有碱性,与酸反应生成盐,而浓硫酸具有酸性和强氧化性,苯胺能与浓硫酸反应,则不能选用浓硫酸,三颈烧瓶内的反应结束后,关闭K,先在三颈烧瓶中加入生石灰后蒸馏,故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】二氧化碳是引起“温室效应”的主要物质,对其有效的回收利用,不仅能缓解能源危机,又可减少温室效应的影响,具有解决能源问题和环保问题的双重意义。
(1)![]() 和
和![]() 经过催化重整可以得到合成气(
经过催化重整可以得到合成气(![]() 和
和![]() );
);
![]()
①一定温度和压强下,由元素最稳定的单质生成![]() 纯化合物时的反应热称为该化合物的标准摩尔生成焓。已知
纯化合物时的反应热称为该化合物的标准摩尔生成焓。已知![]() 、
、![]() 、
、![]() 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为![]() 、
、![]() 、
、![]() 。则上述重整反应的
。则上述重整反应的![]() ________
________![]() 。
。
②其他条件相同,甲、乙两种不同催化剂作用下,相同时间内测得![]() 转化率
转化率![]() 与温度变化关系如图Ⅰ,
与温度变化关系如图Ⅰ,![]() ________(填“可能一定”或“一定未”)达到平衡状态理由是________。
________(填“可能一定”或“一定未”)达到平衡状态理由是________。

(2)![]() 与
与![]() 可以用来生产尿素
可以用来生产尿素![]() ,其反应过程为:
,其反应过程为:![]() ;
;
①![]() 时,在
时,在![]() 的密闭容器中充人
的密闭容器中充人![]() 和
和![]() 模拟工业生产。投料比
模拟工业生产。投料比![]() ,如图Ⅱ是
,如图Ⅱ是![]() 平衡转化率
平衡转化率![]() 与
与![]() 的关系。则图中
的关系。则图中![]() 点
点![]() 的平衡转化率
的平衡转化率![]() _______。
_______。
②当![]() 时,若起始的压强为
时,若起始的压强为![]() ,水为液态,平衡时压强变为起始的
,水为液态,平衡时压强变为起始的![]() 。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数![]() ________
________![]() 。
。


(3)以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率的变化情况如图Ⅲ所示。250-300℃时,温度升高而乙酸的生成速率降低的原因是________。
②为了提高该反应中![]() 的转化率,可以采取的措施是________。
的转化率,可以采取的措施是________。
(4)纳米二氧化钛膜中的![]() 电对吸附
电对吸附![]() 并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入
并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入![]() 进行电解,在阴极可制得低密度聚乙烯
进行电解,在阴极可制得低密度聚乙烯![]() ,(简称
,(简称![]() )。电解时,
)。电解时,![]() 最终转化为
最终转化为![]() 的电极反应式是________。
的电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
B.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
C.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
D.14g聚丙烯中含C—H键总数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列实验事实所得出的相应结论不正确的是( )
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01mol·L-1的酸性KMnO4溶液分别与0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反应,后者退色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,相同温度下发生如下反应:H2(g)+I2(g) | 当其他条件不变时,纯气态反应体系的压强越大,化学反应速率越快 |
D | 将少量MnO2粉末加入盛有10%H2O2溶液的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生变化 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为
A.-Y kJ/molB.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/molD.+(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下:
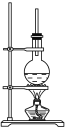
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(![]() )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为![]() )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①![]()
![]()
②![]()
![]()
③![]()
![]()
则![]() 的
的![]() ________(用含
________(用含![]() 、
、![]() 、
、![]() 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①下列说法正确的是________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加![]() 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时![]() 的浓度为1.4 mol·L1,充入一定量的
的浓度为1.4 mol·L1,充入一定量的![]() ,反应再次达到平衡,
,反应再次达到平衡,![]() 浓度________(填“
浓度________(填“![]() ”“
”“![]() ”或“
”或“![]() ”) 1.4 mol·L1。
”) 1.4 mol·L1。
⑶在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,若仅发生反应:
,若仅发生反应: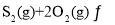
![]() ,
,![]() 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则![]() 内,
内,![]() 的反应速率为________
的反应速率为________![]() 。
。
⑷在恒容密闭容器中,加入足量的![]() 和
和![]() ,仅发生反应:
,仅发生反应:![]()
![]()
![]() 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
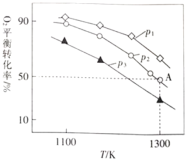
①![]() ________(填“
________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)0;比较
”)0;比较![]() 、
、![]() 、
、![]() 的大小:________。
的大小:________。
②若初始时通入![]() ,
,![]() 为
为![]() ,则
,则![]() 点平衡常数
点平衡常数![]() ________(用气体平衡分压代替气体平衡浓度计算,分压
________(用气体平衡分压代替气体平衡浓度计算,分压![]() 总压
总压![]() 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
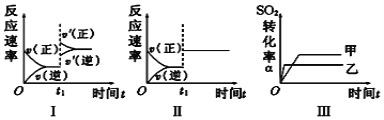
A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ表示的是温度对平衡的影响,且甲的温度小于乙的温度
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com