
| ||
| �� |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
 2NH3�����淴Ӧ������ȫ���е��ף���Ӧ���ת���ʲ��ܴﵽ100%�����¶��µ�1molN2��3molH2����һ�ܱ������У���������2molNH3����Ӧ�ų�������С��92.0kJ��
2NH3�����淴Ӧ������ȫ���е��ף���Ӧ���ת���ʲ��ܴﵽ100%�����¶��µ�1molN2��3molH2����һ�ܱ������У���������2molNH3����Ӧ�ų�������С��92.0kJ��
| ||
| �� |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
| 2 |
| 2.5 |


 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��12�֣���֪���з�Ӧ��
![]() �� N2(g)+3H2(g)
�� N2(g)+3H2(g) ![]() 2NH3(g)����H����92.4 kJ��mol��1��
2NH3(g)����H����92.4 kJ��mol��1��
�� 4NH3(g)+5O2(g)=====4NO(g)+6H2O(g)����H<0
��1����500�桢2.02��107Pa��������������һ�ܱ������г���1molN2��3molH2,��ַ�Ӧ�ų�������______(�<����>����=��)92.4kJ��������______________________________ ____��
��2��Ϊ��Ч���������ת���ʣ������Ͽɲ�ȡ�Ĵ�ʩ��__________��
A.�����¶� B.���ʺϴ������Ե��ʵ����� C.����ѹǿ D.����ѹǿ
E.ѭ�����úͲ��ϲ��䵪�� F.��ʱ�Ƴ���
��3����Ӧ�ڵĻ�ѧƽ�ⳣ������ʽK=________________________��
�¶Ƚ���ʱ��Kֵ______________�����������С������Ӱ�족����
��4����0.5L���ܱ������У�����2.5molN2 �� 7.5mol H2�����÷�Ӧ�ﵽƽ��ʱ�����ƽ�������������ʵ���Ϊ6 mol����ƽ��ʱ������ת����=
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ����һ�и߶�ģ���⻯ѧ�Ծ� ���ͣ������
��12�֣���֪���з�Ӧ��
�� N2(g)+3H2(g) 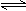 2NH3(g)����H����92.4 kJ��mol��1��
2NH3(g)����H����92.4 kJ��mol��1��
�� 4NH3(g)+5O2(g)=====4NO(g)+6H2O(g)����H<0
��1����500�桢2.02��107Pa��������������һ�ܱ������г���1molN2��3molH2,��ַ�Ӧ�ų�������______(�<����>����=��)92.4kJ��������______________________________ ____��
��2��Ϊ��Ч���������ת���ʣ������Ͽɲ�ȡ�Ĵ�ʩ��__________��
| A�������¶� | B�����ʺϴ������Ե��ʵ����� | C������ѹǿ | D������ѹǿ |
 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ɽ��ʡ�߶�ģ���⻯ѧ�Ծ� ���ͣ������
��12�֣���֪���з�Ӧ��
 �� N2(g)+3H2(g)
�� N2(g)+3H2(g)  2NH3(g)����H����92.4 kJ��mol��1��
2NH3(g)����H����92.4 kJ��mol��1��
�� 4NH3(g)+5O2(g)=====4NO(g)+6H2O(g)����H<0
��1����500�桢2.02��107Pa��������������һ�ܱ������г���1molN2��3molH2,��ַ�Ӧ�ų�������______(�<����>����=��)92.4kJ��������______________________________ ____��
��2��Ϊ��Ч���������ת���ʣ������Ͽɲ�ȡ�Ĵ�ʩ��__________��
A.�����¶� B.���ʺϴ������Ե��ʵ����� C.����ѹǿ D.����ѹǿ
E.ѭ�����úͲ��ϲ��䵪�� F.��ʱ�Ƴ���
��3����Ӧ�ڵĻ�ѧƽ�ⳣ������ʽK=________________________��
�¶Ƚ���ʱ��Kֵ______________�����������С������Ӱ�족����
��4����0.5L���ܱ������У�����2.5mol N2 �� 7.5mol H2�����÷�Ӧ�ﵽƽ��ʱ�����ƽ�������������ʵ���Ϊ6 mol����ƽ��ʱ������ת����=
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com