
����Ŀ��������ѧ֪ʶ�ش�
��1�����������ҹ�����Ѹ�ͷ�չ��Ϊ���ǵij��д��������������������·�Ӧ�������죺 8Al+3Fe3O4 ![]() 4Al2O3+9Fe���÷�Ӧ��������ȡ������ȡ�����Ӧ����Ӧ�еĻ�ԭ�������ѧʽ����
4Al2O3+9Fe���÷�Ӧ��������ȡ������ȡ�����Ӧ����Ӧ�еĻ�ԭ�������ѧʽ����
��2����Ԫ����NaCl��Na2O2��NaHCO3��Na2SiO3�ȶ�����Ҫ�Ļ�������������ѡ���ƵĻ�����Ļ�ѧʽ��գ����г�������ΪDZˮͧ�ͺ��������������Դ�ĵ���ɫ������ �� ���������Ƹ�㣬Ҳ����������ҩ���� ��
��3����FeCl2��Һ��ͨ��Cl2 �� ��Ӧ�����ӷ���ʽΪ2Fe2++Cl2=2Fe3++2Cl�� �� ��������Һ�еμ�KSCN��Һ����Һ���ɫ�����ǿ���������һ�������Fe3+�Ĵ��ڣ�
���𰸡�
��1�����ȣ� Al
��2��Na2O2�� NaHCO3
��3����
���������⣺��1��8Al+3Fe3O4 ![]() 4Al2O3+9Fe�Ƿ��ȷ�Ӧ��AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ�����ʴ�Ϊ�����ȣ�Al����2�����������ܹ���ˮ��������̼��Ӧ������������2Na2O2+2CO2=2Na2CO3+O2������ΪDZˮͧ�ͺ��������������Դ��̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼���ܹ������ᷴӦ�����ڱ��Ƹ�㣬Ҳ����������ҩ���ʴ�Ϊ��Na2O2��NaHCO3�� ��3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ���ʴ�Ϊ���죮
4Al2O3+9Fe�Ƿ��ȷ�Ӧ��AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ�����ʴ�Ϊ�����ȣ�Al����2�����������ܹ���ˮ��������̼��Ӧ������������2Na2O2+2CO2=2Na2CO3+O2������ΪDZˮͧ�ͺ��������������Դ��̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼���ܹ������ᷴӦ�����ڱ��Ƹ�㣬Ҳ����������ҩ���ʴ�Ϊ��Na2O2��NaHCO3�� ��3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ���ʴ�Ϊ���죮
��1����Ӧ8Al+3Fe3O4 ![]() 4Al2O3+9Fe�У�AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ����FeԪ�ػ��ϼ۽��ͣ�����ԭ��Al2O3Ϊ���������ɴ˷�����𣻣�2�����������ܹ���ˮ��������̼��Ӧ����������̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼����3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ��
4Al2O3+9Fe�У�AlԪ�ػ��ϼ����ߣ���������Ϊ��ԭ����FeԪ�ػ��ϼ۽��ͣ�����ԭ��Al2O3Ϊ���������ɴ˷�����𣻣�2�����������ܹ���ˮ��������̼��Ӧ����������̼���������ȷֽ�����̼���ơ�ˮ�Ͷ�����̼����3���������ӵ���Һ�еμ�KSCN��Һ����Һ��ΪѪ��ɫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ�õ�������ҩƷ�ܴﵽʵ��Ŀ���ǣ�������
A | B | C | D |
|
| ����NaHSO3��Һ | |
����Ȳ�ķ���װ�� | ����ʱ�Ľ���װ�� | ��ȥSO2�е�����HCl | ȷ��ȡһ�����K2Cr2O7����Һ |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��������Ҫ������Դ�����Ŀ����������Ӧ�ã��ǵ�ǰ���ǹ�ע���ȵ�֮һ��
(1)�������ܵķ���֮һ�Ƿֽ�ˮ����������������������_______����ܡ����ܡ�������ˮ�ֽ����������������
(2)�ø�ѹ��������������������ȼ�ϵ��������Դ���õ�һ����Ҫ��ʽ��ij����ȼ�ϵ�ص������缫�ļ��Ա�־ģ�����壬С��������ͼ��ʾװ�ý���ʵ���жϡ�

�ٸ��ݹ۲쵽�������жϵ缫a(��b)���ԣ���ʯī1���渲��һ���ɫ���壬��a�缫��_____����,
��д��U���������ĵ缫��Ӧʽ��______________������________��Ӧ���������������ԭ���������һ��ʱ�������������6.4g�������·��ͨ���ĵ��ӵ����ʵ�����________mol�����õ�ⷴӦ����ĵ���ȫ��������ȼ�ϵ���ṩ����������Ҫ����__________ L��������״���£�����������Ҫ��
��.������ʻ��ijЩ�������������̣�����������ŷų�NOx��CO��SO2���к����塣
(1)NOx�Ի�������ҪӰ����___________������ĸ��ţ���
A������������ B������ЧӦ C�� �ƻ������� D�� �⻯ѧ����
(2)Ϊ�˼������Ͳ��ͳ��ŷ�NOx����β������װ�����Զ������������Һ��һ����������ת��ΪNH3��NH3����NOx��Ӧ������������Ⱦ�����ʡ�����NH3��NO2��һ�������·�Ӧ�Ļ�ѧ����ʽΪ_________��
(3)ͨ��CO�������ɼ��CO�ĺ������乤��ԭ��Ϊ2CO+O2=2CO2��ʾ��ͼ���£�

��ͨ��CO��һ��Ϊ_______�����������������������������������Һ��H+����_____�����A����B������
��д��B�缫�ĵ缫��Ӧʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������о�����Ҫ�����á�̼ԭ�ӱ����Ļ�ѧ���ʣ�ʹ���ܹ�ͨ����ѧ�����ӳ������Ӷ��γɸ����������ӡ�����˵�������ϵ���������̼Ԫ�صĻ����Ͻ��������ġ�������ʵ����˵��
A. CԪ��������еĵĻ�����
B. CԪ���������������������Ԫ��
C. CԪ���Ǹ��ִ�����к�������Ԫ��
D. CԪ�ر�����Ԫ����Ҫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����25 mL0.1mol/L��NaOH��Һ�У���μ���0.2 mol/L��CH3COOH��Һ����Һ��pH��CH3COOH ��Һ�����ϵ��ͼ��ʾ�������й�����Ũ�ȹ�ϵ��ȷ����

A. ������A��B�������һ��:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B��:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C��:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. D��:c(CH3COO-)+c(CH3COOH)=2c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��H��N����Ԫ��������Ļ�ѧ�ɷ��У�����������ռ73%���ң�ռϸ�����صİٷֱȣ���������ʯȦ�Ļ�ѧ�ɷ��У�������������1%����һ��ʵ˵���� ��
A. ����������������������
B. ����������������ͳһ��
C. �������������������
D. �������������ı�����ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѧϰ���о���ѧ����Ҫ����ʵ�飬��������¿��⣺
��1����������������Ҫ���������֣���ش��������⣺ a������ b������ c��պȡ��Һ
��ʵ��������һ�����ʵ���Ũ����Һ���������ܽ�ʱ����������������������ĸ����
�ڽ��ձ��е���Һע������ƿʱ����������������������ĸ����
����Ũ������鰱��ʱ����������������������ĸ����
�ܴ����ᴿʱ���ù��˵ķ�����ȥ�����Ե���ɳ����������������������ĸ����
��2������98%��ŨH2SO4���ѣ�=1.84g/cm3������Ũ��Ϊ0.5mol/L��ϡ����500mL�� ��ѡ�õIJ�������������Ͳ�����������ձ������õ��� ��
�ڽ�ŨH2SO4���ձ��ڱ�����ע��ʢˮ���ձ��У����Ͻ����Ŀ���� �� �������������Һ�彦������ʹ���ս�����ƫ�ߡ�����ƫ�͡�����Ӱ�족����
�۶���ʱ����ʹ��Һ��Һ����̶������У������ӻ�ʹ������ƫ�ߡ�����ƫ�͡�����Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ���,H2S�Ǽ�NO��CO֮��ĵ�����������ϵ�����źŷ��ӣ������в���������źŴ��ݡ�����Ѫ�ܼ����Ѫѹ�Ĺ��ܡ�����ʱ��H2S��ˮ�еĵ��볣��Ka1=1.3��10-7,Ka2=7.0��10-15����Ҫ��ش���������:
(1)H2S��ˮ�еĶ������볣������ʽKa2=______;0.1mol/LNa2S��Һ������Ũ���ɴ�С��˳��Ϊ__________.
(2)������,��0.1mol/LH2S��Һ��ͨ��HCl�����NaOH����,���c(S2-)����ҺpH�Ĺ�ϵ��ͼ(������Һ����ı仯��H2S�Ļӷ�)��

�ٵ���Һ��c(S2-)=1.4��10-19mol/Lʱ,��Һ��c(OH-)=______,ˮ���������c(H+)=______.
�ڵ�pH=13ʱ,��Һ�е�c(H2S)+c(HS-)=_______.
(3)�ڹ�ҵ��ˮ�����г���H2S��Mn2+ת��ΪMnS��ȥ��������,����0.010mol��L-1 Mn2+��ˮ��ͨ��H2S�Ե��ڷ�ˮ��pH,��c(HS-)=2.0��10-4mol��L-1ʱ,Mn2+��ʼ��������ʱ��ˮ��pH=___��[��֪Ksp(MnS)=1.4��10-15]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۶������Ҷ�������PES����һ������ɽ���ľ������������ϱ�Ĥ��ʳƷ��װ��������Ϸ������Ź㷺��Ӧ�ã���ṹ��ʽΪ�� 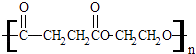 �پ۶������Ҷ�������PES���������ֵ���ͨ����Ӧ���Ӧ���ͣ��Ƶõģ��γɸþۺ�������ֵ������� ��
�پ۶������Ҷ�������PES���������ֵ���ͨ����Ӧ���Ӧ���ͣ��Ƶõģ��γɸþۺ�������ֵ������� ��
�������ֵ����֮��Ҳ�����γ�һ�ְ�Ԫ��״������д���û�״������Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com