
在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
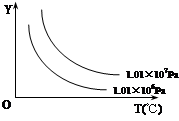
A.反应物A的百分含量 B.反应物B的平衡转化率
C.平衡混合气的密度 D.平衡混合气的总物质的量
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:单选题
已知2SO2(g) + O2(g) 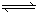 2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若降低温度,可以减慢反应速率 |
| B.催化剂既能加快化学反应速率,又能提高SO2的转化率 |
| C.氧气足量时,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应N2O4 2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
| A.②③④ | B.①②③ | C.①③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
恒容容器中反应:A(g)+3B(g)  2C(g)+3D(g),达到平衡的标志是
2C(g)+3D(g),达到平衡的标志是
①体系的压强不再改变 ②混合气体的平均相对分子质量不再改变 ③各组分的浓度不再改变 ④混合气体的密度不变 ⑤反应速率vA: vB: vC: vD=1:3:2:3 ⑥单位时间内1 mol A断键反应,同时2 mol C也断键反应
| A.②③⑤⑥ | B.②③④⑤ | C.①④⑤⑥ | D.①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应2CO(g)+ O2(g) 2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是 ( )
2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是 ( )
| A.恒容通入少量He | B.恒容通入少量CO2 | C.升高温度 | D.缩小容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于判断过程的方向的说法正确的是 ( )
| A.所有自发进行的化学反应都是放热反应 |
| B.判断化学反应能否自发进行,必须综合考虑反应的焓变和熵变 |
| C.自发反应一定是熵增大,非自发反应一定是熵减小的反应 |
| D.同一物质的固、液、气三种状态中固体的熵值最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知N2(g)+3H2(g)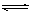 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
| A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ |
| B.H2的百分含量相同 |
| C.N2的转化率:平衡I<平衡Ⅱ |
| D.反应放出的热量:QⅠ=QⅡ<92.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com