
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co,工艺流程简图如下: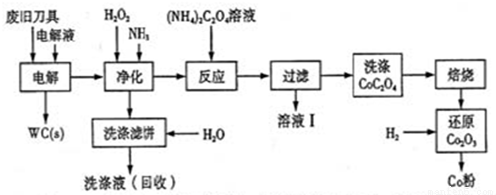
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液,阴极主要的电极反应为 ;
(2)净化步骤所得滤饼的主要成分是Fe(OH)3,回收的洗涤液代替水配制电解液,目的是回收利用其中的 ;
(3)溶液I的主要成分是NH4Cl,洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 ;
(4)将Co2O3还原成Co粉的化学方程式为 。
(1)2H++2e-=H2↑
(2)Fe(OH)3 Co2+
(3) NH4C,焙烧时NH4Cl分解放出NH3和HCl气体
(4)3H2+Co2O3 2Co+3H2O
2Co+3H2O
【解析】
(1)电解时阴极得到电子,由于HCl是电解质溶液,所以阴极是氢离子放电生成氢气,电极反应式是2H++2e-=H2↑;
(2)电解时阳极是铁失去电子,生成亚铁离子,然后加入双氧水将亚铁离子氧化生成铁离子,在加入氨水则生成氢氧化铁沉淀,即净化步骤所得滤饼的主要成分是Fe(OH)3;回收的洗涤液中含有Co2+。
(3)由于电解质溶液是盐酸,在反应过程中加入了氨水和草酸铵,所以过滤后溶液I的主要成分是NH4Cl;洗涤CoC2O4不充分,会附着氯化铵,在煅烧是氯化铵分解生成氨气和氯化氢,从而造成环境污染。
(4)氢气还原Co2O3生成CO粉的同时,还有水生成,反应的化学方程式是
3H2+Co2O3 2Co+3H2O。
2Co+3H2O。


科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
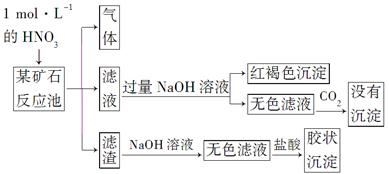
(1)Si在周期表中的位置是___________________________________。
(2)下列说法正确的是________。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是________,滤渣和NaOH溶液反应的离子方程式是_________________________________________________________。
(4)该矿石和1 mol·L-1HNO3反应的离子方程式为
___________________________________________________________。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中。目的是____________________________________;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol·L-1 HNO3的体积为________L。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:
(1)O、S、Se的电负性最小的是 ,它们的氢化物中沸点由高到低的顺序是 (用化学式表示)。
(2)硒的低价含氧酸盐—亚硒酸钠(Na2SeO3),能促进细胞DNA的增殖活性,延缓细胞衰老,SeO32-中的Se原子杂化方式是 ,空间构型为 ;
(3)镉(Cd)与锌为同族相邻元素,在周期表中Cd位于 区,Cd 的最外层电子排布图是 。
(4)锌单质晶体是六方最密堆积,原子按 (填“ABABAB”或“ABCABCABC”)的方式堆积而成,晶体中Zn原子的配位数为 ,锌易与某些小分子物质形成配合物,在[Zn(NH3)4]2+离子中提供孤电子对的原子是 (填元素符号)。
(5)镉和锌都是电的良导体,非金属晶体石墨也具有良好的导电性,下图为石墨晶体结构示意图及提供的资料,12g石墨晶体中正六边形的数目为 ,石墨的密度为 g·cm-3。(阿伏加德罗常数为NA)
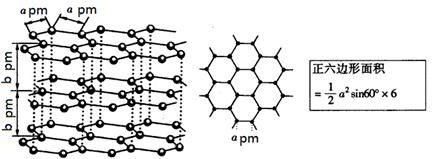
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快 二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)
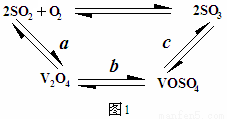
其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,
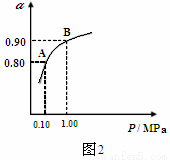
则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
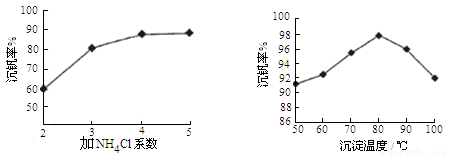
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下:

则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习2(解析版) 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,其相关信息如下表:
元素 | 相关信息 |
X | X的最高价氧化物对应的水化物化学式为H2XO3 |
Y | Y是地壳中含量最高的元素 |
Z | Z的基态原子最外层电子排布式为3s23p1 |
W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是 。氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
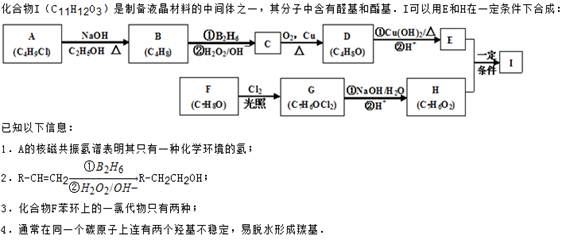
回答下列问题:
(1)A的化学名称为_________。
(2)D的结构简式为_________。
(3)E的分子式为 。
(4)F生成G的化学方程式为________,该反应类型为__________。
(5)I的结构简式为___________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、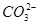 、
、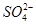 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验:
第一份加入足量AgNO3溶液,得干燥沉淀3.50 g。
第二份加足量BaCl2溶液后,得干燥沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是
①一定存在Mg2+;②可能存在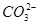 ;③一定存在Cl-;④可能存在Ba2+;⑤可能存在Mg2+
;③一定存在Cl-;④可能存在Ba2+;⑤可能存在Mg2+
A.①③ B.②③ C.③⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使石蕊试液变红的溶液中:I-、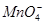 、
、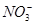 、Na+
、Na+
B.含有大量Fe3+的溶液: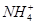 、
、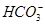 、
、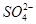 、
、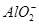
C.水电离出c(H+)=1.0×10-12mol/L的溶液:Cl-、Na+、ClO-、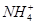
D.澄清透明的溶液:Cu2+、Fe3+、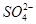 、
、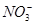
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com