
氢化钙(CaH2中H为﹣1价)可作为生氢剂,反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,下列说法错误的是( )
|
| A. | CaH2既是氧化剂,又是还原剂 |
|
| B. | H2既是氧化产物,又是还原产物 |
|
| C. | CaH2是还原剂,H2O是氧化剂 |
|
| D. | 氧化产物与还原产物的质量比为1:1 |
考点:
氧化还原反应.
专题:
氧化还原反应专题.
分析:
反应CaH2+2H2O=Ca(OH)2+2H2↑中,CaH2中H元素为﹣1价,在反应中升高为0;H2O中H元素为+1价,在反应中降低为0,以此来解答.
解答:
解:A.CaH2中H元素为﹣1价,在反应中升高为0,则为还原剂,而H2O中H元素为+1价,在反应中降低为0,则为氧化剂,故A错误;
B.由反应可知,氧化产物与还原反应均为氢气,故B正确;
C.CaH2中H元素为﹣1价,在反应中升高为0,则为还原剂,而H2O中H元素为+1价,在反应中降低为0,则为氧化剂,故C正确;
D.氧化产物与还原反应均为氢气,其物质的量相同,则氧化产物与还原产物的质量比为1:1,故D正确;
故选A.
点评:
本题考查氧化还原反应,明确元素的化合价是解答本题的关键,并熟悉氧化还原反应中的基本概念来解答,难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42﹣)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混和液中K+的物质的浓度为()
A. 0.2mol/L B. 0.25mol/L C. 0.45mol/L D. 0.225mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象与实验结论一致的是()
选项 实验操作、现象 实验结论
A 向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,再加入稀盐酸沉淀不消失 该溶液中含有SO42﹣
B 用铂丝蘸取某溶液进行焰色反应,
火焰呈黄色 该溶液中一定含有Na+,
C 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变为黄色 H2O2的氧化性比Fe3+强
D 向溶液中加入新制氯水,再加几滴KSCN溶液溶液变红 该溶液中一定含有Fe2+
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z为三种单质.已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物的水溶液中置换出来.由此可以推断下列说法中可能正确的是( )
①单质的氧化性:Y>Z>X; ②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y; ④对应离子的还原性:X>Z>Y.
|
| A. | 只有① | B. | 只有②③ | C. | 只有①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据阿伏加德罗理论:在相同温度和压强下,相同体积的任何气体都含有相同数目的粒子.在一定温度和压强下,1体积的A2气体和3体积的B2气体合成2体积的C气体,则C气体的化学式为( )
|
| A. | AB | B. | AB3 | C. | A3B | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能存在下列阴离子:Cl﹣、SO42﹣、CO32﹣中的一种或几种.
(1)当溶液中存在大量H+时, 不能在溶液中大量存在;
(2)当溶液中存在大量Ag+时, 不能在溶液中大量存在;
(3)当向溶液中加入Ba(NO3)2溶液能生成白色沉淀,则原溶液中存在的离子是 ﹣ ;为了进一步确定的溶液中存在哪种离子,可继续向溶液中加入 ,通过观察 再作出进一步的判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 摩尔是7个基本物理量之一
B. 18 g水在标准状况下的体积约为22.4 L
C. 27 g Al约含有6.02×1023个铝原子
D. 配制0.1 mol/L的NaCl溶液需NaCl固体的质量为5.85 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的说法正确的是()
A. 乙醇和乙酸都存在碳氧双键
B. 甲烷和乙烯都可以与氯气反应
C. 高锰酸钾可以氧化苯和乙醛
D. 乙烯可以与氢气发生加成反应,苯不能与氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
美丽中国,节约为荣.“开源节流”是应对能源危机的重要举措.请回答下列问题:
(1)下列做法不利于能源“开源节流”的是b(填序号).
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少煤、石油等化石燃料的使用
d.减少资源消耗,增加资源的重复使用,注重资源的循环再生
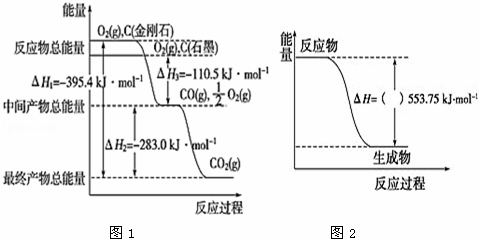
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应放出的热量如图1所示:
①在通常状况下,石墨(填“金刚石”或“石墨”)更稳定,石墨的燃烧热△H= .
②又已知:2H2(g)+O2(g)═2H2O(l)△H2=﹣571.6kJ•mol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=﹣2599.2kJ•mol﹣1根据盖斯定律及以上信息,写出C(石墨)与H2(g)反应生成1molC2H2(g)的热化学方程式: .
(3)丙烷(C3H8)是一种优良的气体燃料.试回答下列问题:
①如图2是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图(图中括号内“+”或“﹣”未标注),写出表示丙烷燃烧热的热化学方程式: .
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔,1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量,若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com