
| A. | v(X)=0.005 mol•L-1•s-1 | B. | v(Z)=0.01 mol•L-1•s-1 | ||
| C. | v(Y)=0.01 mol•L-1•s-1 | D. | v(M)=0.025 mol•L-1•s-1 |
分析 根据v=$\frac{△c}{△t}$计算v(NO),利用速率之比等于化学计量数之比计算v(NH3).
解答 解:30s后,Z的物质的量增加了3mol,则v(Z)=$\frac{\frac{3mol}{5L}}{30s}$=0.02mol/(L•s),速率之比等于化学计量数之比,X为固体不用来表示化学反应速率,则v(Y)=$\frac{3}{4}$v(Z)=$\frac{3}{4}$×0.02 mol/(L•s)=0.015mol/(L•s),v(M)=$\frac{5}{4}$v(Z)=$\frac{5}{4}$×0.02mol/(L•s)=0.025mol/(L•s),
故选D.
点评 本题考查化学反应速率的有关计算,比较基础,化学反应速率常用计算有:定义法与化学计量数法,根据情况选择合适的计算方法.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.
已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.| A. | -124 | B. | +124 | C. | -288 | D. | +288 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在标准状况下22.4LH2中含有的氢分子的个数为NA | |
| B. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA | |
| C. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- | |
| D. | 某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
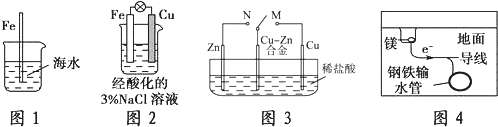
| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 | |
| C. | 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大 | |
| D. | 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
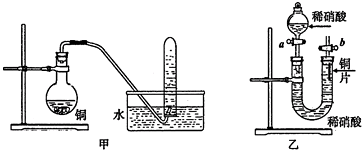
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,所以不能用氯气对自来水进行消毒 | |
| B. | 液氯是纯净物,而氯水是混合物 | |
| C. | 碘化钾水溶液能使淀粉变蓝 | |
| D. | 在一个反应中,氧化剂和还原剂不可能是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
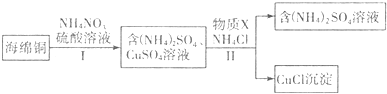
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com