
【题目】实验是实现科学探究的重要途径。
(1)下列关于教材实验的叙述中正确的是
A.Cu片加入冷的浓硫酸中没有变化,说明Cu在浓硫酸中也会钝化
B.石油分馏时,控制温度,收集到的汽油为纯净物
C.用激光笔照射肥皂水,有丁达尔效应,说明肥皂水是胶体
D.淀粉水解液中加入银氨溶液,水浴加热后无银镜,说明淀粉未水解
E.鸡蛋白溶液中分别加入饱和硫酸铵、硫酸钾溶液时,都发生了盐析
(2)某兴趣小组设计出下图装置(气密性已检查),验证铜与稀硝酸反应的产物。
已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
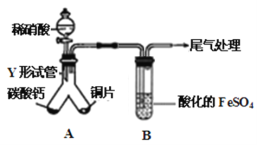
①实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
②由分液漏斗向Y形试管右侧加入稀硝酸,反应的离子方程式是
。
③本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
【答案】(1)CE
(2)①用CO2排除装置中的空气,避免NO被氧化
②3Cu + 2NO3— + 8H+ = 3Cu2+ +2NO↑+4H2O
③ 溶液变黄色(Fe2+被氧化成Fe3+); 溶液变为棕色
【解析】
试题分析:(1)A、铜常温下在浓硫酸中不反应,错误;B、汽油不是纯净物,错误;C、胶体有丁达尔效应,故正确;D、淀粉水解时加入硫酸做催化剂,所以水解后应加入氢氧化钠中和酸,再加入银氨溶液发生银镜反应,故错误;E、蛋白质溶液加入硫酸铵发生盐析,故正确。故选CE;(2)①因为反应中硫酸亚铁和一氧化氮反应,而一氧化氮容易与空气中的氧气反应生成二氧化氮,所以先用碳酸钙和硝酸反应生成二氧化碳,排除装置中的空气,避免NO被氧化;②铜和稀硝酸反应生成硝酸铜和一氧化氮和水,离子方程式为:3Cu + 2NO3— + 8H+ = 3Cu2+ +2NO↑+4H2O;③ 二氧化氮可以和水反应生成硝酸硝酸能将亚铁离子氧化生成铁离子,溶液变黄色(Fe2+被氧化成Fe3+);若只有一氧化氮,则一定量[Fe(NO)]2+时突显明显棕色。


科目:高中化学 来源: 题型:
【题目】(16分)如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
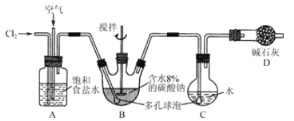
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)① 实验中控制氯气与空气的体积比的方法是 。
② 为使反应充分进行实验中采取的措施有 。
(2)① 装置B中产生Cl2O的化学方程式为 。
② 若B无冷却装置,进入C中的Cl2O会大量减少。其原因是 。
(3)装置C中采用棕色圆底烧瓶是因为 。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案为:用 量取20.00 mL次氯酸溶液, 。
(可选用的试剂有H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届唐山二模】目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
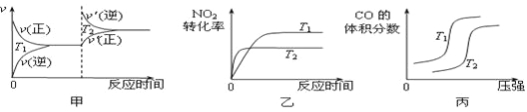
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO2)= ;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
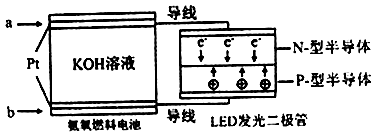
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Al、Si 、Cl、Fe是七种常见元素
(1)N元素位于周期表第 周期,第 族。
(2)用“>”、“<”或“= ”填空:
离子半径 | 得电子能力 | 酸性 | 金属性 |
O2― Al3+ | 16O 18O | H2CO3 HNO3 | Fe Al |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目: 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为 ,电池负极反应的电极方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
(1)已知:CO燃烧热△H2=-283kJ·mol-1。几种化学键键能数据如下:
化学键 | N=N键 | O=O键 |
|
键能/kJ·mol-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g) △H3= ,上述△H1= 。
(2)CO——空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),则负极的电极反应式为 。
(3)2CO(g)+2NO(g)![]() N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。
N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。

(4)当NO、CO的浓度比为1时,体系中NO平衡转化率(α)与温度、压强的关系如图B所示。α(NO)随着温度升高而 (填“增大”或“减小”),其原因是 。图B中,压强由小到大的顺序为 ,其判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
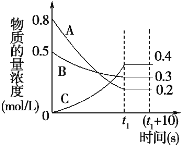
(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有浓度都为0.1mol·L-1HX、HY的溶液各20ml,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。

下列判断错误的是
A.滴定过程中,水电离的c(H+)·c(OH-)均不变
B.HX的电离程度小于HY的电离程度
C.V=10ml时,c(HX)+c(X-)=2c(Na+)
D.V=20ml时,c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。
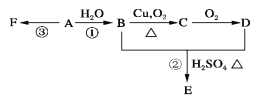
(1)A的分子式为________________。
(2)写出:反应①的化学方程式: ;该反应的类型是_______________。反应③的化学方程式:_____________________________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:
____________________________________________________________
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为_____________;A与该烃的体积比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
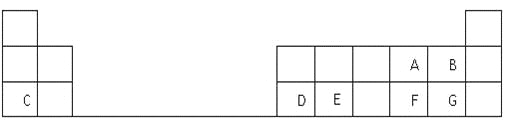
(1)G在元素周期表中的位置是 。
(2)A、B、C三种元素的简单离子半径由大到小的顺序为 (用离子符号表示)。
(3)写出C和F两种元素形成的化合物的电子式 ,
(4)元素E是构成地壳的主要元素之一,其氧化物是制光导纤维的基本原料,该氧化物中含有的化学键是 键(填“离子”或“共价”),属于 晶体(填晶体类型),写出该氧化物与C元素最高价氧化物水化物反应的离子方程式 。
(5)C离子的氧化性比D离子的氧化性 ,(填“强”或“弱”),其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com