
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 白炽灯工作时,电能全部转化为光能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 绿色植物的光合作用时,将光能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
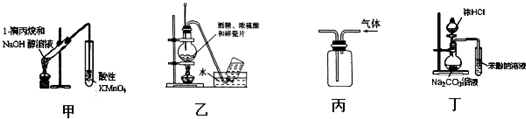
| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
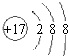
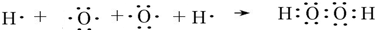
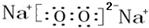 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 第ⅠA族和第ⅦA族原子化合时,一定生成离子键 | |
| C. | 由非金属元素形成的化合物一定不是离子化合物 | |
| D. | 离子化合物中可能同时含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com