
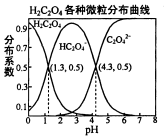
 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )
常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )| A. | HC2O4-?H++C2O42-,K=1×10-4.3 | |
| B. | 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液PH恰好为4.3 | |
| C. | 常温下HF的KB=1×10--3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4- | |
| D. | 在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-) |
分析 A.K=$\frac{c({H}^{+})×c({C}_{2}{{O}_{4}}^{2-})}{c(H{C}_{2}{{O}_{4}}^{-})}$,pH=4.3时,c(C2O42-)=c(HC2O4-);
B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,HC2O4-电离程度大于C2O42-的水解程度;
C.根据电离常数判断酸性强弱,酸性强的制备酸性弱的;
D.NaHC2O4溶液显酸性,以HC2O4-的电离为主,在溶液中部分电离HC2O4-.
解答 解:A.由HC2O4-?H++C2O42-,可知K=$\frac{c({H}^{+})×c({C}_{2}{{O}_{4}}^{2-})}{c(H{C}_{2}{{O}_{4}}^{-})}$,pH=4.3时,c(C2O42-)=c(HC2O4-),所以K=$\frac{c({H}^{+})×c({C}_{2}{{O}_{4}}^{2-})}{c(H{C}_{2}{{O}_{4}}^{-})}$=c(H+)=1×10-4.3,故A正确;
B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,HC2O4-电离程度大于C2O42-的水解程度,所以溶液中c(C2O42-)>c(HC2O4-),则溶液PH大于4.3,故B错误;
C.常温下H2C2O4的K1=10-1.3,K2=10-4.3,HF的KB=1×10-3.45,则酸性:H2C2O4>HF>HC2O4-,所以将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为H2C2O4+F-=HF+HC2O4-;故C正确;
D.NaHC2O4溶液显酸性,以HC2O4-的电离为主,在溶液中部分电离HC2O4-,则各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-),故D正确.
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,明确溶液中的溶质组成为解答的关键,并注意利用溶液中水解的程度及电离的程度、电荷守恒来分析解答.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7 | |
| B. | 同体积、同密度的C2H4和CO,两种气体的分子数一定相等 | |
| C. | 配制450ml0.1mol•L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g | |
| D. | 1L0.45mol•L-1NaCl溶液中Cl-的物质的量浓度比0.1L0.15mol•L-1AlCl3溶液大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 配制CuSO4溶液 | 将硫酸铜晶体溶于热水中,然后稀释 |
| B | 除去试管内壁的银镜 | 加入浓氨水浸泡,再用蒸馏水洗涤 |
| C | 提纯含少量乙酸的乙醇(乙醇沸点78.5℃) | 加入生石灰后进行蒸馏,收集78.5℃馏分 |
| D | 证明HClO为弱酸 | 用洁净的玻璃棒蘸取NaClO溶液在pH试纸上,待试纸变色后与标准比色对照 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3分子的空间构型为三角锥形 | |
| B. | 叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-,则N2O与N3-互为等电子体 | |
| C. | 叠氮化物与Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,则其中钴的配位数为8 | |
| D. | NaN3与KN3的结构类似,则NaN3的晶格能大于KN3的晶格能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | Si | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,X 的转化率为50% | |
| B. | 该握度下平衡常数K=10(10mol•L-1)-1 | |
| C. | 10min内生成物Z 的反应速率0.02mol•L-1•min-1 | |
| D. | 若Y是有色气体,只压缩容器的体积,则体系颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥的Cl2能用钢瓶贮运 | |
| B. | 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 | |
| C. | SiO2可用于制备光导纤维 | |
| D. | HF溶液不能贮存在磨口玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Z>Y>X | |
| B. | R元素的氧化物对应水化物和W元素的氧化物对应水化物,酸性前者强 | |
| C. | X和Z形成的化合物能溶于NaOH溶液 | |
| D. | Y和X形成的化合物中,阴阳离子的个数比可能为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com