
| A. | Na2O属于碱性氧化物 | |
| B. | Na2CO3长期暴露在空气中变为NaHCO3 | |
| C. | NaOH溶液保存在带玻璃塞的玻璃瓶中 | |
| D. | 向NaHCO3溶液中滴加稀盐酸,开始时无想象,一段时间后有气泡产生 |
分析 A、碱性氧化物是指能与酸反应生成盐和水的金属氧化物;
B、Na2CO3长期暴露在空气中仍为Na2CO3;
C、氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性;
D、向NaHCO3溶液中滴加稀盐酸,立即生成气泡.
解答 解:A、氧化钠与酸反应生成盐、水,则Na2O属于碱性氧化物,故A正确;
B、Na2CO3长期暴露在空气中仍为Na2CO3,不会变为NaHCO3,故B错误;
C、氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以不能盛放在带有玻璃塞的试剂瓶中,故C错误;
D、向NaHCO3溶液中滴加稀盐酸,碳酸氢根离子与氢离子立即反应放出二氧化碳气体,所以立即生成气泡,故D错误;
故选A.
点评 本题考查钠的化合物,明确发生的化学反应及相关的概念是解答本题的关键,难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铁通常用作红色油漆和涂料 | |
| B. | 用铝制餐具长期存放碱性食物 | |
| C. | 过氧化钠可以用作潜水艇里氧气的来源 | |
| D. | 硅可用于制作电脑芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的沸点高于HCl | B. | 金刚石的熔点比晶体硅高 | ||
| C. | 稀有气体一般很难发生化学反应 | D. | 常温下单质溴呈液态、碘呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 铁粉与硫粉需要加热才能发生的反应,则此反应是吸热反应 | |
| D. | 1mol甲烷燃烧生成水和二氧化碳所放出的热量就是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
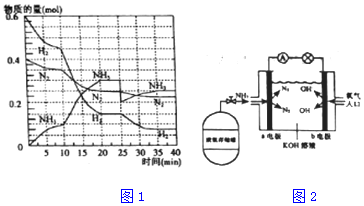
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
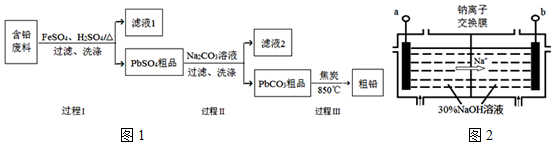
 2PbSO4+2H2O.
2PbSO4+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 发生的现象 | 解释或结论 |
| A | 向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液 | 产生白色沉淀 | 产生的亚硫酸钡是难溶解于水的沉淀 |
| B | 将SO2通入滴有酸性高锰酸钾溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 常温下铜片插入硝酸中 | 产生白色沉淀 | 常温下铜和硝酸一定产生NO2 |
| D | 向某溶液中加入NaHCO3 | 产生白色沉淀 | 该溶液可能原来含有氢氧化钡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若选用酚酞作指示剂,终点时,液体恰好褪色 | |
| B. | 用量筒量取上述盐酸 | |
| C. | 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大 | |
| D. | 盐酸的浓度为1.00 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com